题目内容
12.三个容器中分别盛有H2、CH4、O2,已知三个容器中气体的温度、密度都相等,下列说法正确的是( )| A. | 三种气体质量相等 | B. | 三种气体的物质的量之比为16:2:1 | ||
| C. | 三种气体压强比为16:8:1 | D. | 三种气体体积比为1:8:16 |
分析 A.容器的容积不确定,无法确定质量;
B.容器的容积不确定,无法确定物质的量;
C.根据PV=nRT=$\frac{m}{M}$RT得PM=ρRT;
D.容器的容积不确定,无法确定气体体积.
解答 解:A.相同温度下,三种气体的密度相等,但容器体积未知,无法计算其质量,故A错误;
B.相同温度下,三种气体的密度相等,但容器体积未知,无法计算其质量,也无法计算其物质的量之比,故B错误;
C.根据PV=nRT=$\frac{m}{M}$RT得PM=ρRT,氢气的摩尔质量是2g/mol,甲烷的摩尔质量是16g/mol、氧气的摩尔质量是32g/mol,气体的温度、密度都相等,其压强之比等于其摩尔质量的反比,所以其压强之比为16:8:1,故C正确;
D.容器的容积不确定,无法确定气体体积,故D错误;
故选C.
点评 本题考查了阿伏伽德罗定律及其推论,灵活运用公式是解本题关键,注意PV=nRT理解阿伏伽德罗定律及其推论,题目难度不大.

练习册系列答案
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
3.下列化学反应的离子方程式不正确的是( )
| A. | Na2S溶液中加入少量FeCl3溶液:2Fe3++S2-═2Fe2++S↓ | |
| B. | 向NaOH溶液中滴加碳酸氢钙溶液至OH-恰好完全反应:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| C. | 向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O═SO42-+Cl-+2H+ | |
| D. | Na2CO3溶液中滴入少量邻羟基苯甲酸溶液: +CO32-→ +CO32-→ +HCO3- +HCO3- |
20.下列化学表达方式不正确的是( )
| A. | 中子数为20的氯原子:37Cl | B. | Cl-的结构示意图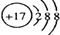 | ||
| C. | 氢氧根离子的电子式: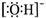 | D. | HClO的结构式 H-Cl-O |
7.原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1.a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同.下列叙述错误的是( )
| A. | a和其他3种元素均能形成共价化合物 | |
| B. | 元素的非金属性次序为c>b>a | |
| C. | d和其他3种元素均能形成离子化合物 | |
| D. | 元素a、b、c各自最高和最低化合价的代数和分别为0、4、6 |
17.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的H+数为2NA | |
| C. | 42g乙烯和丙烯的混合气体充分燃烧消耗氧气的分子数为4.5 NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
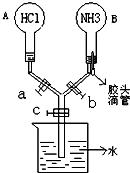 如图所示的装置,实验前a、b、c活塞均关闭.
如图所示的装置,实验前a、b、c活塞均关闭.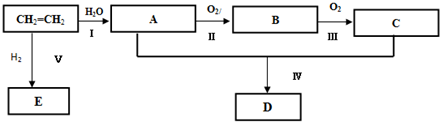
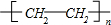 ;反应类型:加聚反应
;反应类型:加聚反应