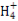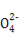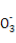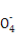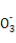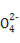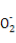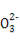题目内容
下列溶液中有关微粒的物质的量浓度或物理量关系正确的是( )
A.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HR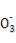 )+2c(R
)+2c(R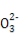 )
)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
C.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(N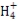 ):①<③<②
):①<③<②
D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数:N前>N后
A
【解析】选项A中混合液中的电荷守恒式为c(H+)+c(Na+)=c(OH-)+c(HR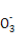 )+2c(R
)+2c(R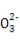 ),在中性溶液中c(H+)=c(OH-),因此选项A正确。选项B同样可以先写出混合溶液中的电荷守恒式:c(H+)+c(Na+)=c(OH-)+c(Cl-)+c(CH3COO-),又由于溶液呈中性,即c(H+)=c(OH-),因此混合溶液中应有c(Na+)=c(Cl-)+c(CH3COO-),根据物料守恒可得c(Na+)=c(CH3COOH)+c(CH3COO-),所以有c(Na+)>c(Cl-)=c(CH3COOH),选项B错误。对于选项C,Fe2+的存在会抑制N
),在中性溶液中c(H+)=c(OH-),因此选项A正确。选项B同样可以先写出混合溶液中的电荷守恒式:c(H+)+c(Na+)=c(OH-)+c(Cl-)+c(CH3COO-),又由于溶液呈中性,即c(H+)=c(OH-),因此混合溶液中应有c(Na+)=c(Cl-)+c(CH3COO-),根据物料守恒可得c(Na+)=c(CH3COOH)+c(CH3COO-),所以有c(Na+)>c(Cl-)=c(CH3COOH),选项B错误。对于选项C,Fe2+的存在会抑制N 的水解,C
的水解,C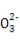 的存在会促进N
的存在会促进N 的水解,因此选项C错误。根据电荷守恒可知选项D是错误的。
的水解,因此选项C错误。根据电荷守恒可知选项D是错误的。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案下表是3种物质的溶解度(20 ℃),下列说法中正确的是( )
物质 | MgCl2 | Mg(OH)2 | MgCO3 |
溶解度(g/100 g) | 74 | 0.000 84 | 0.01 |
A.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(C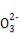 ),且c(Mg2+)·c(C
),且c(Mg2+)·c(C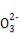 )=6.82×10-6
)=6.82×10-6
B.将表中三种物质与水混合,加热、灼烧,最终的固体产物相同
C.除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液
D.用石灰水处理含有Mg2+和HC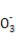 的硬水,发生的离子反应方程式为Mg2++2HC
的硬水,发生的离子反应方程式为Mg2++2HC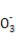 +Ca2++2OH-
+Ca2++2OH- CaCO3↓+MgCO3↓+2H2O
CaCO3↓+MgCO3↓+2H2O