题目内容
【题目】镁合金及镁的化合物在生产、生活中有着广泛的应用。
(1)镁在元素周期表中的位置是____________。
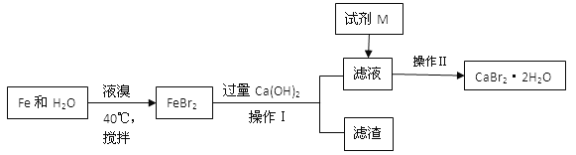
(2)用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁的关键流程如下:

① 一段脱水后,残留固体质量占原样品质量的64.5%,试确定生成物的化学式__________。② 二段脱水时,溶入H2和Cl2燃烧产物的目的是__________。
③ 该工艺中可循环使用的物质有_____________
(3)储氢材料Mg(AlH4)2在110-200℃的反应为:Mg(AlH4)2 =MgH2 +2Al+3H2↑,每转移6mol电子生成氢气的物质的量为__________mol。
(4)碱式碳酸镁密度小,是橡胶制品的优良填料,可用复盐MgCO3·(NH4)2CO3·2H2O作原料制备。
① 40℃时,复盐开始热解生成MgCO3·3H2O,并有气体产生,该反应的化学方程式为________。
② 制备过程中,需要用到卤水(氯化镁溶液)。某科研小组用沉淀滴定法分析产品中Cl-的含量,称取6.1000g产品用适量硝酸溶解,经稀释等步骤最终配得500mL 的溶液。
a.准确量取25.00mL 待测液,用0.1000 mol/ L AgNO3 标准液滴定,滴定前后滴定管中的液面读数如图所示,则滴定过程中消耗标准液的体积为______________mL。

b.
AgCl | AgBr | AgI | Ag2CrO4 | |
Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
颜色 | 白 | 淡黄 | 黄 | 砖红 |
参照上表数据及信息分析,滴定时可以作指示剂的是________(填数字序号)。
① CaCl2 ② NaBr ③ NaI ④ K2CrO4
c.滴定时,应将溶液调成中性,不能是强酸性或强碱性,其中不能是强碱性的原因是________。
d.产品中氯的质量分数为___________(保留三位有效数字)。
【答案】 第三周期第ⅡA族 MgCl2·H2O 防止MgCl2·2H2O脱水过程中发生水解反应 HCl、Cl2 3 MgCO3·(NH4)2CO3·2H2O![]() MgCO3·3H2O+CO2↑+2NH3↑ 16.00 ④ 碱性条件下AgNO3会生成Ag2O 18.6%
MgCO3·3H2O+CO2↑+2NH3↑ 16.00 ④ 碱性条件下AgNO3会生成Ag2O 18.6%
【解析】 (1)镁为12号元素,在元素周期表中位于第三周期第ⅡA族,故答案为:第三周期第ⅡA族;
(2)①图中AB线段为“一段脱水”,设对应固体物质的化学式为MgCl2xH2O,根据![]() =0.645,计算得 x=2,所以B的化学式为MgCl22H2O,故答案为:MgCl22H2O;
=0.645,计算得 x=2,所以B的化学式为MgCl22H2O,故答案为:MgCl22H2O;
②二段脱水中通入HCl可以抑制MgCl2的水解,故答案为:为防止MgCl22H2O脱水过程中发生水解反应;
③根据制备金属镁工艺的关键流程分析,循环使用的物质是加入后在反应过程中又重新生成的物质,分析可知是氯气和氯化氢,故答案为:HCl,Cl2;
(3)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,反应中生成3molH2转移电子6mol,所以每转移6mol电子生成3mol H2,故答案为:3;
(4)①根据元素守恒可知,复盐开始热解生成MgCO33H2O,并有气体产生,该气体应为二氧化碳和氨气,所以反应的化学方程式
为MgCO3·(NH4)2CO3·2H2O![]() MgCO3·3H2O+CO2↑+2NH3↑ ,故答案为:MgCO3·(NH4)2CO3·2H2O
MgCO3·3H2O+CO2↑+2NH3↑ ,故答案为:MgCO3·(NH4)2CO3·2H2O![]() MgCO3·3H2O+CO2↑+2NH3↑ ;
MgCO3·3H2O+CO2↑+2NH3↑ ;
② a.根据滴定前后滴定管中的液面读数可知硝酸银标准液的体积为18.5mL-2.5mL=16.00mL,故答案为:16.00;
b. 指示剂的作用是指示出氯离子恰好沉淀完全,即让氯离子先沉淀,沉淀完全后,再滴入硝酸银溶液会生成一种颜色不同的沉淀来指示沉淀终点,氯化银、溴化银、碘化银的组成都是1:1,依据Ksp可以直接比较溶解性大小为氯化银>溴化银>碘化银;随Ksp的减小,应先出现碘化银沉淀、再出现溴化银,最后才沉淀氯化银,所以①、②、③不符合滴定实验的目的和作用,铬酸银的阳、阴离子个数比为2:1,可以计算相同浓度的银离子沉淀氯离子、铬酸根离子需要的浓度,依据Ksp计算得到,Ksp(AgCl)= c(Ag+)c(Cl-)=2×10-10,Ksp(Ag2CrO4)= c(Ag+)2 c(CrO42-) =2.0×10-12,c(Cl-)=![]() ,c(CrO42-)=
,c(CrO42-)=![]() ;所以同浓度的银离子需要的氯离子浓度小于铬酸根离子浓度,说明铬酸银溶解度大于氯化银;加入K2CrO4,做指示剂可以正确的测定氯化物的含量,故④正确;故答案为:④;
;所以同浓度的银离子需要的氯离子浓度小于铬酸根离子浓度,说明铬酸银溶解度大于氯化银;加入K2CrO4,做指示剂可以正确的测定氯化物的含量,故④正确;故答案为:④;
c.碱性条件下,硝酸银会生成氢氧化银或氧化银沉淀,影响沉淀滴定,所以滴定时,溶液不能是强碱性,故答案为:碱性条件下,硝酸银会生成氢氧化银或氧化银沉淀;
d. 根据氯离子的物质的量与反应的硝酸银的物质的量相等可知,n(Cl-)=0.016L×0.1000 mol/ L=0.0016mol,产品中氯的质量分数=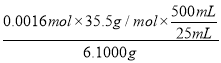 ×100%=18.6%,故答案为:18.6%。
×100%=18.6%,故答案为:18.6%。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案