题目内容
【题目】关于下列各图的叙述错误的是 ( )


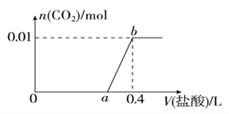
A. 已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);ΔH= - 483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B. 常温下0.2 mol·L-1 HA溶液和0.1mol·L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(A-)> c(Na+)>c(H+)>c(OH-)
C. 常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐减小,且HX的还原性逐渐减弱
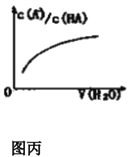
D. 图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,![]() 的变化情况
的变化情况
【答案】C
【解析】A、据已知反应结合盖斯定律可求得1molCO和1molH2O(g)生成1molCO2和1molH2放热41.2kJ,A正确;B、所得溶液为相同浓度的NaA和HA的混合溶液,HA的浓度为0.1mol/L,pH=3,说明HA是弱酸,且HA的电离程度大于NaB的水解程度,所以c(B-)>c(Na+)>c(H+)>c(OH-),B正确;C、平衡常数只能表示反应程度的大小,无法比较HX的还原性强弱,C错误;D、弱酸加水稀释时,促进弱酸的电离,导致A离子浓度比HA浓度减小慢,D正确;答案选C。

【题目】在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法 | 现象 | 结论 | |
A | 观察氯水颜色 | 氯水呈黄绿色 | 氯水中含Cl2 |
B | 向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C | 向红色纸条上滴加氯水 | 红色纸条褪色 | 氯水具有漂白性 |
D | 向FeCl2溶液中滴加氯水 | 溶液变成棕黄色 | 氯水具有氧化性 |
A. A B. B C. C D. D