题目内容
下列叙述正确的是
- A.1个甘氨酸分子中存在9对共用电子
- B.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
- C.H2S和CS2分子都是含极性键的极性分子
- D.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅
D
由甘氨酸(H2N—CH2—COOH)可以确定分子中含有10对共用电子;写出PCl3和BCl3的电子式,可以判断只有B原子最外层为6个电子,其它均为8个电子;H2S(类似于H2O)和CS2(类似于CO2)分别是极性键构成的极性分子和非极性分子;金刚石、碳化硅、硅都属于原子晶体,但原子半径C<Si,原子半径越小,结合得越牢固所得的晶体的熔点越高。
由甘氨酸(H2N—CH2—COOH)可以确定分子中含有10对共用电子;写出PCl3和BCl3的电子式,可以判断只有B原子最外层为6个电子,其它均为8个电子;H2S(类似于H2O)和CS2(类似于CO2)分别是极性键构成的极性分子和非极性分子;金刚石、碳化硅、硅都属于原子晶体,但原子半径C<Si,原子半径越小,结合得越牢固所得的晶体的熔点越高。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
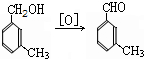
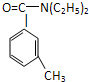 避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH
避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH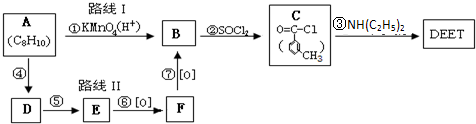
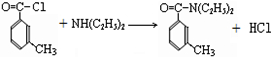
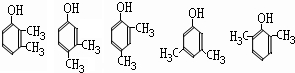 (任写2种)
(任写2种)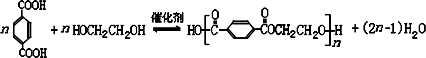
 NH3?H2O+H+
NH3?H2O+H+ (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.