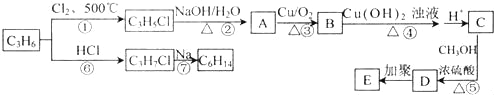
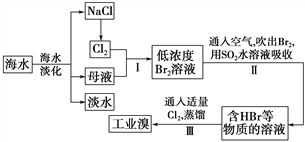
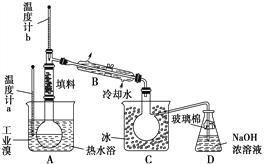
题目内容
【题目】仔细阅读下列三段文字。
①由稀有气体元素Xe(氙)与氧元素形成的一种共价化合物XeO3极不稳定,易转化为单质而呈强氧化性。将适量的XeO3投入含Mn2+的水溶液中,溶液逐渐变为紫红色且pH不断减小。
②将0.08mol KMnO4固体加热一段时间后,收集到a molO2;向反应后残留的固体中加入足量的浓盐酸,又收集到b molCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
③氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:Cl2+2e-=2Cl-
回答问题:
(1)试写出有关①的离子方程式 。
(2)请配平②的化学方程式:
KMnO4+ HCl- KCl+ MnCl2+ Cl2↑+ H2O
通过对第②段文字中提供的数据计算出a+b的最大值为 。
(3)从Na2CO3、KMnO4、XeO3、Na2SO3四种物质中选出一种能使③中的还原过程能够发生,并将该反应的氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥表示电子转移的方向和数目: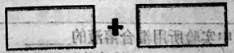 。
。
【答案】
(1)5XeO3+6Mn2++9H2O=6MnO4-+5Xe↑+8H+
(2)2 16 2 5 5 8 0.2mol
(3)![]()
【解析】
试题分析:(1)反应中Xe元素化合价由XeO3+6价降低为Xe中0价,总共降低6价,Mn元素化合价由Mn2+中+2价升高为MnO4-中+7价,总共升高5价,化合价最小公倍数为30,故XeO3系数为5,故Mn2+系数为6,再结合原子守恒配平后方程式为5XeO3+6Mn2++9H2O=6MnO4-+5Xe↑+18H+,故答案为:5XeO3+6Mn2++9H2O=6MnO4-+5Xe↑+18H+;
(2)Mn元素的化合价降低5,Cl元素的化合价升高1,由电子守恒和原子守恒可知,反应为2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,上述过程中,锰元素得到的电子数等于O元素、Cl元素失去的电子数,所以0.08mol×(7-2)=2a×(2-0)mol+2b(1-0)mol,则2a+b=0.2,a+b=0.2-a,当高锰酸钾不分解生成氧气时,a=0,当高锰酸钾完全分解生成氧气时,生成氧气的物质的量为0.04mol,所以x的取值范围为:0≤a≤0.04,所以0.16≤a+b≤0.2,即最大值为0.2mol。故答案为:2;16;2;2;5;8;0.2mol;
(3)③中还原过程的反应式:Cl2+2e-═2Cl-,Cl元素的化合价降低,则选项中物质作还原剂,只有Na2SO3符合,由电子守恒可知,Cl2、Na2SO3的化学计算数相同,均为1时转移2e-,S失去电子,电子转移方向和数目为![]() ,故答案为:D;
,故答案为:D;![]() 。
。

 字词句段篇系列答案
字词句段篇系列答案