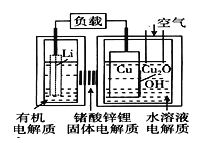
题目内容
【题目】工业上制备纯硅反应的热化学方程式:SiCl4(g)+2H2(g)===Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是
A. 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应
B. 反应过程中,若增大压强能提高SiCl4的转化率
C. 若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
D. 反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol·L-1·min-1
【答案】A
【解析】
根据化学反应速率的定义、计算公式分析;根据外界条件对化学平衡移动的影响分析。
由方程式可知,当反应吸收热量为0.025QkJ时,生成HCl的物质的量为:0.025QkJ/QKJ·mol-1×4=0.1mol,100mL1mol/L的NaOH的物质的量为:0.1L×1mol/L=0.1mol,二者物质的量相等,恰好反应,故A正确;
从方程式可以看出,反应物气体的计量数之和小于生成物气体的计量数之和,则增大压强,平衡向逆反应方向移动,SiCl4的转化率减小,故B错误;
该反应为可逆反应,具一定的限度,故1molSiCl4不能完全转化,达到平衡时,吸收热量一定小于QkJ,故C错误;
反应至4min时,若HCl浓度为0.12mol/L,则v(HCl)= 0.12mol/L÷4min =0.03mol/(Lmin),根据反应速率之比等于化学计量数之比,则v(H2)= ![]() ×v(HCl)=
×v(HCl)=![]() ×0.03mol/(Lmin)=0.015mol/(Lmin),故D错误。
×0.03mol/(Lmin)=0.015mol/(Lmin),故D错误。
故选A。

【题目】二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
S | 112.8 | 444.6 | 略 |
S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S;与过量氯气发生S2Cl2+Cl2 温度超300℃以上完全分解为硫和氯气 |
设计实验装置图如下:

(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见_______________________。
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式为_________________________________________________________。
(3)C、D中的试剂分别是_________________、_____________________。
(4)仪器A、B的名称分别是___________、___________,F的作用是_______________________。
(5)如果在加热E时温度过高,对实验结果的影响_________________________________;在F中可能出现的现象是________________________________________________。
(6)S2Cl2粗品中可能混有的杂质是(填写两种物质的化学式)______________、_____________,为了提高S2Cl2的纯度,关键的操作是控制好温度和_____________________________________。