题目内容
下列离子方程式正确的是
| A.为缓解胃酸过多,服含NaHCO3的抗酸药:HCO3-+H+=H2O+CO2↑ |
| B.FeSO4溶液被氧气氧化:4Fe2++O2+2H2O=4Fe3++4OH- |
| C.硫酸铝溶液中加入过量的氨水:Al3++3OH-=Al(OH)3↓ |
| D.将Na2O2加入H2O中:Na2O2+H2O=2Na++2OH-+O2↑ |
A
解析试题分析:A、碳酸氢根离子不可再拆,正确;B、产物中Fe3+与OH-不可共存,应写成Fe(OH)3的形式;C、氨水为弱碱,应写化学式;D、不满足质量守恒。
考点:考查离子方程式的正误判断。

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
下列离子方程式与所述事实相符且正确的是( )
| A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B.向Na2SO3溶液中通入足量氯气:SO32-+Cl2+H2O=SO42-+2Cl-+2H+ |
| C.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-=Mn2++Cl2↑+2H2O |
| D.钠与CuSO4溶液反应:2Na+Cu2+===Cu+2Na+ |
下列离子方程式正确的是
| A.1mol Cl2通入含有2mol FeI2的溶液中:2Fe2++2I﹣+2Cl2=2Fe3++4Cl﹣+I2 |
| B.澄清石灰水与少量小苏打溶液混合:Ca2++OH﹣+HCO3﹣=CaCO3↓+H2O |
| C.AlCl3溶液中加入过量氨水:Al3++4OH﹣=AlO2﹣+2H2O |
| D.向银氨溶液中加入足量的盐酸:[Ag(NH3)2]++OH﹣+3H+=Ag++2NH4++H2O |
下列热化学方程式或离子方程式中,正确的是
| A.0.01mol·L-1NH4Al(SO4)2溶液与0.02mol·L-1Ba(OH)2溶液等体积混合: NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
| B.一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g) 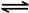 2NH3(g)△H=-38.6kJ·mol-1 2NH3(g)△H=-38.6kJ·mol-1 |
| C.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+==AgBr↓ |
| D.CO(g)的燃烧热是283.0 kJ·mol-1,则CO2分解的热化学方程式为: |
水溶液中能大量共存的一组离子是
| A.Na+、Ca2+、Cl-、SO42- |
| B.Fe2+、H+ 、SO32-、ClO- |
| C.Mg2+、NH4+、Cl-、SO42- |
| D.K+、Fe3+、NO3-、SCN- |
下列与化学概念有关的说法正确的是
| A.电解、电离的过程都需要消耗电能 |
| B.元素的非金属性越强,对应单质的活泼性一定越强 |
| C.有单质参加或生成的化学反应一定是氧化还原反应 |
| D.只含共价键的物质不一定是共价化合物 |
下列离子或分子组中大量共存且满足相应要求的是( )
| A.K+、AlO2-、Cl-、MnO4-要求:无色澄清溶液 |
| B.Fe3+、NO3-、I-、HCO3-要求:逐滴滴加盐酸立即产生气体 |
| C.Na+、K+、Ag+,NO3-要求:逐滴滴加氨水先有沉淀产生,后沉淀消失 |
| D.NH4+、Al3+、SO42-、CH3COOH要求:滴加NaOH浓溶液立刻产生气体 |
下列离子方程式正确的是( )
| A.过氧化钠和水反应:2Na2O2+2H2O=4Na++4 OH—+O2↑ |
| B.用铜为电极电解饱和食盐水:2Cl—+2H2O通电Cl2↑+H2↑+2OH— |
| C.在明矾溶液中滴加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
| D.向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是
| 选项 | 离子组 | 加入试剂 | 离子方程式 |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+2NH4++Ba2++2OH-===BaSO4↓+2NH3·H2O |
| B | Mg2+、HCO3-、Cl- | 过量NaOH溶液 | Mg2++2HCO3-+4OH-===2H2O+Mg(OH)2↓+2CO32- |
| C | K+、NH3·H2O、CO32- | 通入少量CO2 | 2OH-+CO2===CO32-+H2O |
| D | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+===SO2↑+H2O |