题目内容
(18分)下表中a、b、c…为周期表中部分元素,回答下列问
(1)在表中用线画出元素周期表的边界
(2)请写出上述元素d3+的核外电子排布式 ;
(3)请比较y、h、i三种元素的第一电离能由大到小的顺序 (写元素符号),判断依据是:
(4)请写出e元素的原子价电子轨道表示式 ;
(5)ya3分子的电子式是 ,其分子的空间构型是 。
(6)e元素最高价氧化物对应的水化物呈_______性(酸性、碱性或两性),用离子方程式说明____________________________________________ 。
| a | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | f | y | h | i | |
| | b | | | | | | | | | | | e | | | | j | |
| c | | | | | | | d | | | | g | | l | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
(2)请写出上述元素d3+的核外电子排布式 ;
(3)请比较y、h、i三种元素的第一电离能由大到小的顺序 (写元素符号),判断依据是:
(4)请写出e元素的原子价电子轨道表示式 ;
(5)ya3分子的电子式是 ,其分子的空间构型是 。
(6)e元素最高价氧化物对应的水化物呈_______性(酸性、碱性或两性),用离子方程式说明____________________________________________ 。
| a | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | f | y | h | i | |
| | b | | | | | | | | | | | e | | | | j | |
| c | | | | | | | d | | | | g | | l | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
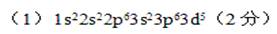
 两性:(2分)略
两性:(2分)略(1)从图中可知,该表格有七行,即表示七个周期;有18列,即表示18个族。所以可以确定其边界应如图:
(2)从d的位置可知其为第四周期第8副族的元素,即铁元素。其原子的电子排布式应为:1s22s22p63s23p63d64s2。铁原子失去最外层的两个电子4s2时就是亚铁离子,在失去3d6中的一个电子,使d亚层达到半满状态。所以d3+的核外电子排布式为:1s22s22p63s23p63d5或[Ar]3d5
(3)从图中可知,y、h、i分别为F、N、O三种元素。
同一周期内元素的第一电离能在总体增大的趋势中有些曲折。当外围电子在能量相等的轨道上形成全空(p0, d0, fo)、半满(p3, d5, f7)或全满(p6, d10, f14)结构时,原子的能量较低,元素的第一电离能较大。所以三种元素的第一电离能由大到小的顺序为:F>N>O
(4)从图中可知:e元素为铝元素,其核外电子排布式为:1s22s22p63s23p1。所以其原子电子轨道表示式:
(5)根据元素周期表可知ya3应为NH3。所以其分子的电子式是: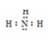
NH3分子的空间构型是:三角锥,中心原子N原子采取SP3杂化
(6)e元素为铝元素,其最高价氧化物对应的水化物为Al(OH)3,属于两性氢氧化物,离子方程式为:Al(OH)3+OH-=AlO2- +2H2O
(2)从d的位置可知其为第四周期第8副族的元素,即铁元素。其原子的电子排布式应为:1s22s22p63s23p63d64s2。铁原子失去最外层的两个电子4s2时就是亚铁离子,在失去3d6中的一个电子,使d亚层达到半满状态。所以d3+的核外电子排布式为:1s22s22p63s23p63d5或[Ar]3d5
(3)从图中可知,y、h、i分别为F、N、O三种元素。
同一周期内元素的第一电离能在总体增大的趋势中有些曲折。当外围电子在能量相等的轨道上形成全空(p0, d0, fo)、半满(p3, d5, f7)或全满(p6, d10, f14)结构时,原子的能量较低,元素的第一电离能较大。所以三种元素的第一电离能由大到小的顺序为:F>N>O
(4)从图中可知:e元素为铝元素,其核外电子排布式为:1s22s22p63s23p1。所以其原子电子轨道表示式:

(5)根据元素周期表可知ya3应为NH3。所以其分子的电子式是:
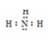
NH3分子的空间构型是:三角锥,中心原子N原子采取SP3杂化
(6)e元素为铝元素,其最高价氧化物对应的水化物为Al(OH)3,属于两性氢氧化物,离子方程式为:Al(OH)3+OH-=AlO2- +2H2O

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
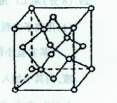
 物;D与B可形成离子化合物,其晶胞结构如右图所示。请回答下列问题。
物;D与B可形成离子化合物,其晶胞结构如右图所示。请回答下列问题。

 构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是 ________
构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是 ________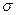 键与
键与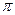 键的数目之比为
键的数目之比为