题目内容
【题目】298 K、101kPa时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )
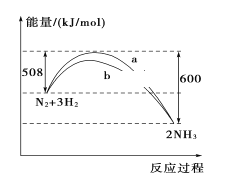
A. 加入催化剂,不能改变该化学反应的反应热
B. b曲线是加入催化剂时的能量变化曲线
C. 该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
D. 在常温、体积一定的条件下,通入1 mol N2和3 mol H2,反应后放出的热量为92 kJ
【答案】D
【解析】
A.催化剂能改变反应的路径,降低反应的活化能,但不能改变化学反应的反应热,A项正确;
B. 加入催化剂,降低反应的活化能,但不改变ΔH,反应速率加快,b曲线符合要求,B项正确;
C.根据图象可知,1molN2和3molH2完全反应生成2molNH3时放出的热量为92 kJ,C项正确;
D.因为该反应为可逆反应,反应不能进行到底,所以通入1molN2和3 molH2,反应后放出的热量小于92 kJ,D项错误;
正确选项D。

练习册系列答案
相关题目