题目内容
【题目】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1。我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5 mg·L-1。水中溶解氧的测定步骤如下:
(1)向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;
(2)加入适量稀H2SO4,搅拌,等MnO(OH)2与I-完全反应生成Mn2+和I2后;
(3)用Na2S2O3标准溶液滴定至终点。
测定过程中物质的转化关系如下:
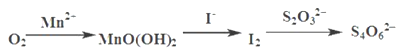
已知:MnO(OH)2+2I-+4H+ =Mn2++I2+3H2O 2S2O32- +I2= S4O62-+2I-
①加入稀硫酸后搅拌的作用是__________;Na2S2O3标准溶液应装在______________滴定管中(填酸式或碱式)。
②滴定过程中以_____________为指示剂;达到滴定终点的标志为____________________。
③写出O2将Mn2+氧化成MnO(OH)2的离子方程式____________________;
④若加入的稀H2SO4溶液反应后,若溶液pH过低,滴定时会产生明显的误差。写出产生误差的一个原因(用离子方程式表示)__________________。
⑤下列操作使测得水样中溶氧量(DO)比实际值偏高的是__________________。
A.第(1)步操作静置时没有密封 B.装Na2S2O3标准溶液的滴定管没有润洗
C.滴定前锥形瓶洗净后没有干燥 D.滴定前读数正确,滴定后俯视读数
⑥取加过一定量CaO2·8H2O的池塘水样l00.00mL,按上述方法测定水中溶解氧量,消耗0.01000
mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧为____________mg·L-1。
【答案】 使溶液混合均匀,加快反应速率 碱式 淀粉溶液 当滴入最后一滴标准液时,溶液蓝色褪去且半分钟内不变色 2Mn2++O2+4OH-=2MnO(OH)2↓ S2O32-+2H+= S↓+ SO2↑+H2O或 SO2+I2+2H2O=4H++SO42-+2I- 或4 I-+4 H++O2=2I2+2H2O AB 10.80
【解析】试题分析:本题考查酸碱中和滴定的拓展实验——氧化还原滴定,考查滴定管和指示剂的选择、滴定终点的判断,误差分析和计算。
①加入稀硫酸后搅拌的作用是:使溶液混合均匀,加快反应速率。Na2S2O3溶液呈碱性,且Na2S2O3具有强还原性,所以Na2S2O3溶液应盛装在碱式滴定管中。
②该实验以标准Na2S2O3溶液滴定I2,所以选用淀粉溶液作指示剂。滴定终点的标志是:滴入最后一滴标准Na2S2O3溶液,溶液由蓝色褪为无色且在半分钟内不恢复。
③依据O2将Mn2+氧化成MnO(OH)2写出:O2+Mn2+→MnO(OH)2↓,根据得失电子守恒配平:O2+2Mn2+→2MnO(OH)2↓,结合原子守恒、电荷守恒和溶液呈碱性,写出离子方程式为:2Mn2++O2+4OH-=2MnO(OH)2↓。
④若溶液pH过低,Na2S2O3会与H+反应,消耗Na2S2O3增多,引起误差,反应的离子方程式为:S2O32-+2H+= S↓+ SO2↑+H2O,生成的SO2会与I2反应:SO2+I2+2H2O=4H++SO42-+2I-;溶液中KI在酸性条件下会被空气中O2氧化成I2,消耗Na2S2O3增多,引起误差,KI被O2氧化的离子方程式为:4 I-+4 H++O2=2I2+2H2O。
⑤根据方程式:2Mn2++O2+4OH-=2MnO(OH)2↓、MnO(OH)2+2I-+4H+ =Mn2++I2+3H2O、2S2O32- +I2= S4O62-+2I-,得出关系式O2~4Na2S2O3,则n(O2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() c(Na2S2O3)V[Na2S2O3(aq)]。A项,第(1)步操作静置时没有密封,空气中的O2进入参与反应,使所耗Na2S2O3标准溶液体积偏大,测得水样中溶氧量比实际值偏高;B项,装Na2S2O3标准溶液的滴定管没有润洗,Na2S2O3被稀释,使所耗Na2S2O3标准溶液体积偏大,测得水样中溶氧量比实际值偏高;C项,滴定前锥形瓶洗净后没有干燥,对测定结果无影响;D项,滴定前读数正确,滴定后俯视读数,所耗Na2S2O3标准溶液体积偏小,测得水样中溶氧量比实际值偏低;答案选AB。
c(Na2S2O3)V[Na2S2O3(aq)]。A项,第(1)步操作静置时没有密封,空气中的O2进入参与反应,使所耗Na2S2O3标准溶液体积偏大,测得水样中溶氧量比实际值偏高;B项,装Na2S2O3标准溶液的滴定管没有润洗,Na2S2O3被稀释,使所耗Na2S2O3标准溶液体积偏大,测得水样中溶氧量比实际值偏高;C项,滴定前锥形瓶洗净后没有干燥,对测定结果无影响;D项,滴定前读数正确,滴定后俯视读数,所耗Na2S2O3标准溶液体积偏小,测得水样中溶氧量比实际值偏低;答案选AB。
⑥根据关系式O2~4Na2S2O3,得出n(O2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() c(Na2S2O3)V[Na2S2O3(aq)]=
c(Na2S2O3)V[Na2S2O3(aq)]= ![]() 0.01000mol/L
0.01000mol/L![]() 0.0135L=3.375
0.0135L=3.375![]() 10-5mol,m(O2)=3.375
10-5mol,m(O2)=3.375![]() 10-5mol
10-5mol![]() 32g/mol=1.08
32g/mol=1.08![]() 10-3g=1.08mg,该水样中的溶解氧为
10-3g=1.08mg,该水样中的溶解氧为![]() =10.80mg/L。
=10.80mg/L。




