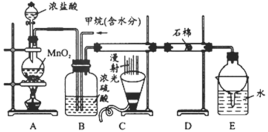
��Ŀ����
����Ŀ��һ�������£������Ϊ5L���ܱ������У���̬����A��B��C�����ʵ���n(mol)��ʱ��t�ı仯��ͼ1��ʾ����֪��ƽ������¶ȣ�A������ٷֺ�������С��
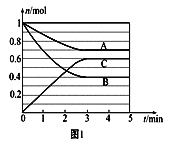
��1��������ͼ���ݣ�д����Ӧ�Ļ�ѧ����ʽ _______���ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ������v(C)=________��
��2���÷�Ӧ����H ______ 0(��������������������=��)��
��3���˷�Ӧƽ�ⳣ���ı���ʽΪK=___________��
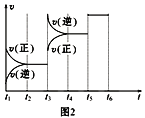
��4���÷�Ӧ�ķ�Ӧ����v��ʱ��t�Ĺ�ϵ��ͼ2��ʾ��
�ٸ�����ͼ�жϣ���t3ʱ�̸ı�����������_______________��
��A��ת��������һ��ʱ����_____________________��
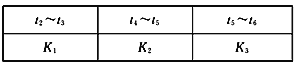
�۸��ε�ƽ�ⳣ�������ʾ��
K1��K2��K3֮��Ĺ�ϵΪ��______(����>������<������=������)��
���𰸡�(1)A��2B![]() 2C 0.04 mol��L��1��min��1
2C 0.04 mol��L��1��min��1
(2)�� (3)![]() (4)�������¶� ��t2��t3��K1>K2=K3
(4)�������¶� ��t2��t3��K1>K2=K3
��������
(1)����ͼ���֪��A��BΪ��Ӧ��,CΪ������ӷ�Ӧ��ʼ����ƽ��Ĺ�����A��B��C�����ʵ����ı仯Ϊ0.3 mol��0.6 mol��0.6 mol�����Է�Ӧ����ʽΪA��2B![]() 2C��C��ƽ������Ϊ0.6 mol/(5 L��3 min)="0.04" mol��L��1��
2C��C��ƽ������Ϊ0.6 mol/(5 L��3 min)="0.04" mol��L��1��
min��1��
(2)��Ӧ�ﵽƽ������¶ȣ�A�����������С��˵�������¶�ƽ��������Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ��
(3)�÷�Ӧ��ƽ�ⳣ������ʽΪK=![]()
(4)��t3ʱ�̸ı����������淴Ӧ���ʶ�������ƽ�����淴Ӧ������У���ı�������������¶ȡ�
��t5ʱ�̸ı��������ʹ�ô�����A��ת���ʲ��䣬������������A��ת��������һ��ʱ����t2��t3��
��Ϊt3�����¶ȣ�t5ʹ�ô������÷�ӦΪ���ȷ�Ӧ����K1>K2=K3

����Ŀ����1L��0.01molNaAlO2��0.02molNaOH����Һ�л���ͨ�������̼����n(CO2)�����Ⱥ���������ͬ�ķ�Ӧ����0.01mol<n(CO2) ![]() 0.015ʱ�����ķ�Ӧ�ǣ�2 NaAlO2+ CO2+2H2O=2Al(OH)3��+Na2CO3���ж�Ӧ��ϵ��ȷ����( )
0.015ʱ�����ķ�Ӧ�ǣ�2 NaAlO2+ CO2+2H2O=2Al(OH)3��+Na2CO3���ж�Ӧ��ϵ��ȷ����( )
ѡ�� | n(CO2)/mol | ��Һ�����ӵ����ʵ���Ũ�� |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
A. A B. B C. C D. D