题目内容
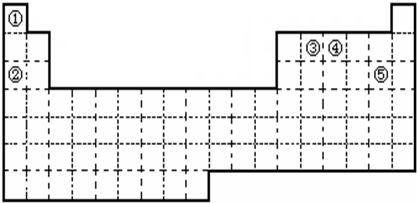
(6分)①~⑤五种元素在元素周期表中的位置如下图所示:回答下列问题:
(1)①~⑤五种元素中,非金属性最强的元素在周期表中的位置是 ;
(2)②③④元素原子中,半径最小的是 (填元素符号);
(3)元素①和③可以形成众成多的化合物,其中最简单的是 (化学式)。该化合物中,化学键的类型为 (选填“极性共价键”、 “非极性共价键”或“离子键”);
(4)元索④的最高价氧化物对应水化物能与其最低价的气态氢化物发生反应,产物是
(化学式);
(5)元素⑤单质与水反应的离子方程式: 。
(1)第三周期,第VIIA族 (2)N (3)CH4 极性共价键
(4)NH4NO3 (5)Cl2+H2O=H++Cl-+HClO
解析:

练习册系列答案
相关题目
 A、B、C、D、E五种元素在元素周期表中的位置如图所示:
A、B、C、D、E五种元素在元素周期表中的位置如图所示: