题目内容
8.对下列实验过程的评价,正确的是( )| A. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| B. | 验证烧碱溶液中是否含有Cl-,先加稀硫酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| C. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| D. | 某溶液中先滴加足量稀盐酸,无明显变化,再滴加少量BaCl2溶液,生成白色沉淀,证明该溶液一定含有SO42- |
分析 A.石蕊遇酸变红;
B.硫酸银是白色沉淀;
C.无色气体为二氧化碳,固体为碳酸盐或碳酸氢盐等;
D.检验是否含有硫酸根离子时,需要排除可能存在的其它微粒如碳酸根离子、亚硫酸根离子、银离子等的干扰.
解答 解:A.石蕊遇酸变红,则无色溶液滴入紫色石蕊试液显红色,该溶液可能显酸性,故A错误;
B.硫酸银是白色沉淀,无法证明含Cl-,故B错误;
C.固体中加入稀盐酸,产生了无色气体,无色气体为二氧化碳,固体可能为碳酸盐或碳酸氢盐等,故C错误;
D.向该溶液中先加了盐酸,排除可能存在的其它微粒如碳酸根离子、亚硫酸根离子、银离子等的干扰,再加入BaCl2溶液,产生了白色沉淀,说明了该沉淀不溶于稀盐酸,应为BaSO4,溶液中含有SO42-,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及指示剂的变色、离子检验等,把握离子检验的试剂、现象和结论的关系及实验技能为解答的关键,侧重实验基本技能的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下列有关化学与自然资源的开发利用描述中正确的是( )
| A. | 冶炼金属钠通常用电解氯化钠溶液的方法 | |
| B. | 要使海水淡化通常有蒸馏法和离子交换法 | |
| C. | 用氯气和氢氧化钠制漂白粉 | |
| D. | 工业冶炼金属铁用铝和三氧化二铁高温下发生铝热反应 |
16.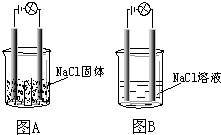 某一化学兴趣小组的同学在家中进行实验,按照图示连接好线路,发现图B中的灯泡亮了.由此得出的以下结论中正确的是( )
某一化学兴趣小组的同学在家中进行实验,按照图示连接好线路,发现图B中的灯泡亮了.由此得出的以下结论中正确的是( )
 某一化学兴趣小组的同学在家中进行实验,按照图示连接好线路,发现图B中的灯泡亮了.由此得出的以下结论中正确的是( )
某一化学兴趣小组的同学在家中进行实验,按照图示连接好线路,发现图B中的灯泡亮了.由此得出的以下结论中正确的是( )| A. | NaCl是非电解质 | |
| B. | NaCl溶液是电解质 | |
| C. | NaCl在水溶液中电离出了可以自由移动的离子 | |
| D. | 在NaCl溶液中,水电离出了大量的离子 |
3.下列能发生水解的粒子是( )
| A. | SO42-? | B. | Na+ | C. | Cl- | D. | CH3COO- |
13.下列说法不正确的是( )
| A. | 常温下,可以用铁、铝制的容器来盛装浓硫酸或浓硝酸 | |
| B. | 实验室中,盛装NaOH溶液的试剂瓶用橡皮塞 | |
| C. | 实验室中,可以用量筒、滴定管、容量瓶准确量取一定体积的液体用于化学反应等 | |
| D. | 实验室中,盛放氢氟酸不能用玻璃瓶 |
20.标准状态下,气态分子断开l mol化学键的焓变称为键能.已知H-H、H-O和O═O键的键能△H分别为436kJ/mol、463kJ/mol和495kJ/mol.下列热化学方程式正确的是( )
| A. | H2O (g)═H2(g)+$\frac{1}{2}$O2(g);△H═-485 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(g);△H═-485 kJ/mol | ||
| C. | 2H2(g)+O2 (g)═2H2O(g);△H═+485 kJ/mol | D. | H2O (g)═H2(g)+$\frac{1}{2}$O2(g);△H═+485 kJ/mol |
17.下列说法不正确的是( )
| A. | 中和热测定实验中,应迅速将NaOH溶液和盐酸在测定装置中混合 | |
| B. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| C. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mL H2O,向另一支试管中加入2mL 5%H2O2和1mL FeCl3溶液,观察并比较实验现象 | |
| D. | 已知4H++4I-+O2=2I2+2H2O,为了利用该反应探究反应速率与温度的关系,所用试剂除1 mol•L-1KI溶液、0.1 mol•L-1稀硫酸外,还需要用到淀粉溶液 |
18.下列反应中,离子方程式书写正确的是( )
| A. | 过量CO2与澄清石灰水反应:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| B. | 向KHSO4溶液中加入Ba(OH)2溶液至所得溶液的pH=7 Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中滴入过量的NaOH溶液Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| D. | 硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |