题目内容
(10分)已知A、B、C、D、E是短周期的5种元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出B、D元素的名称:B ,D 。
(2)画出C元素的离子结构示意图 。
(3)写出D的单质与C的最高价氧化物对应水化物之间反应的离子方程式
(4)A、B、C三种元素形成的化合物所含的化学键类型为 。
(5)B、C、D三种元素的离子半径由大到小的排列顺序为 (用离子符号表示)。
(1)请写出B、D元素的名称:B ,D 。
(2)画出C元素的离子结构示意图 。
(3)写出D的单质与C的最高价氧化物对应水化物之间反应的离子方程式
(4)A、B、C三种元素形成的化合物所含的化学键类型为 。
(5)B、C、D三种元素的离子半径由大到小的排列顺序为 (用离子符号表示)。
(1)B:氧、 D:铝(各1分) (2) 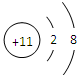 (2分)
(2分)
(3)2A1 + 2OH-+ 2H2O = 2AlO2- + 3H2↑(2分)
(4)离子键、共价键(各1分) (5)O2->Na+ > Al3+ (2分)
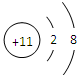 (2分)
(2分)(3)2A1 + 2OH-+ 2H2O = 2AlO2- + 3H2↑(2分)
(4)离子键、共价键(各1分) (5)O2->Na+ > Al3+ (2分)
考查元素周期表的结构、原子核外电子的排布规律及元素周期律的应用。A元素原子形成的离子核外电子数为零,所以A是氢元素。E的单质为黄色晶体,易溶于二硫化碳,则E是单质硫。B与E同主族,所以B是氧元素。C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应,因此一定有铝元素。A与C同主族,且C的原子序数等于氧元素的,所以C是钠元素,则D是铝元素。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以B、C、D三种元素的离子半径由大到小的排列顺序为O2->Na+ > Al3+。

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目