��Ŀ����
����Ŀ����A��B��C��D����ѧ��ѧ�����Ļ���������ᴿ�Ļ���װ�á�
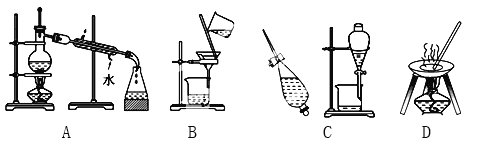
����ݻ���������ᴿ��ԭ�����ش�������ʵ������Ҫʹ����һ��װ�ã���A��B��C��D�����ʵ��Ŀո��С�
��1���ӵ�ˮ����ȡ��_____________________________��
��2��ʵ������ȡ����ˮ_____________________________��
��3��ȥ�����е���ɳ_____________________________��
��4���뺣ˮɹ��ԭ���������___________________________��
���������а������ʣ���HCl�����Cu ��CO ��CO2 �ݽ��ʯ ��KMnO4���� ��Ba(OH)2��Һ ������KAl(SO4)2
��1�����ڵ��ʵ���_________�������������������_________������״̬�ܵ���ĵ������_________��(���������ʵ����)
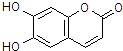
��2��д��Ba(OH)2��ˮ�еĵ��뷽��ʽ��____________________________________________��
��3����˫���ű�ʾ�÷�Ӧ�е���ת�Ƶķ������Ŀ_______
2KMnO4+16HCl=5Cl2��+2MnCl2+2KCl+8H2O
����0.8mol��ԭ������������ת�Ƶ��ӵ����ʵ�����_________��
���𰸡� C A B D �ڢ� �� �� Ba(OH)2=Ba2++2OH- 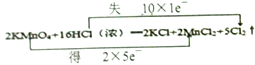 +8H2O 0.8mol
+8H2O 0.8mol
����������1�����������л��ܼ��У��ӵ�ˮ����ȡ����Ҫ��ȡ��Һ����ѡC����2��ʵ������ȡ����ˮ��Ҫ����ѡA����3��ȥ�����е���ɳ��Ҫ���ˣ���ѡB����4����ˮɹ����������ԭ������ѡD��
��1����һ��Ԫ���γɵĴ������ǵ��ʣ����ڵ��ʵ���Cu�����ʯ������Ӧ�����κ�ˮ������������������������������������CO2�����������ƶ����ӻ����ӵ����ʿ��Ե��磬�������״̬�ܵ���ĵ����������KAl(SO4)2����2��Ba(OH)2�Ƕ�Ԫǿ���ˮ�еĵ��뷽��ʽΪBa(OH)2=Ba2++2OH-����3��MnԪ�ػ��ϼ۴�+7�۽��͵�+2�۵õ�5�����ӣ�ClԪ�ػ��ϼ۴ӣ�1�����ߵ�0��ʧȥ1�����ӣ����ݵ��ӵ�ʧ�غ��֪��˫���ű�ʾ�÷�Ӧ�е���ת�Ƶķ������ĿΪ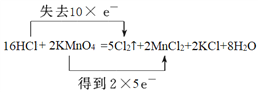 �����ݷ���ʽ��֪����0.8mol��ԭ������������ת�Ƶ��ӵ����ʵ�����0.8mol��
�����ݷ���ʽ��֪����0.8mol��ԭ������������ת�Ƶ��ӵ����ʵ�����0.8mol��

 ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�