题目内容
(13分)下图是实验室制取SO2并验证SO2某些性质的装置图。试回答:
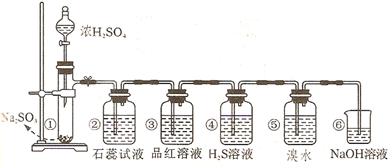
⑴①中发生反应的化学方程式为 。
⑵②中的实验现象为 ,此实验说明SO2是 氧化物。
⑶③的品红溶液 ,证明SO2有 。
⑷④中的实验现象为 ,此实验说明SO2有 性。
⑸⑤中的实验现象为 ,此实验说明SO2有 性。
⑹⑥的作用是 ,反应方程式是 。

⑴①中发生反应的化学方程式为 。
⑵②中的实验现象为 ,此实验说明SO2是 氧化物。
⑶③的品红溶液 ,证明SO2有 。
⑷④中的实验现象为 ,此实验说明SO2有 性。
⑸⑤中的实验现象为 ,此实验说明SO2有 性。
⑹⑥的作用是 ,反应方程式是 。
(1)Na2SO3+H2SO4=Na2SO4+H2O+SO2↑ (2)试液变为红色酸性
(3)褪色漂白性 (4)产生淡黄色沉淀氧化
(5)褪色还原 (6)吸收尾气SO2+2NaOH=Na2SO3+H2O
(3)褪色漂白性 (4)产生淡黄色沉淀氧化
(5)褪色还原 (6)吸收尾气SO2+2NaOH=Na2SO3+H2O
考查SO2的制取及SO2的性质。
⑴①装置是制取SO2的,所以①中发生反应的化学方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑。
(2)SO2是酸性氧化物,溶于水生成亚硫酸,溶液显酸性,因此实验现象是试液变为红色。
(3)SO2还具有漂白性,能使品红溶液褪色。
(4)SO2中S元素的化合价处于中间价态,既有氧化性,还有还原性。由于H2S具有还原性,能被SO2氧化生成单质S,所以实验现象是产生淡黄色沉淀。
(5)溴水具有氧化性,能把SO2氧化生成硫酸,所以实验现象是溴水褪色。
(6)SO2是大气污染物,不能排放在大气中,所以⑥的作用是吸收吸收尾气,防止污染空气,反应的方程式是SO2+2NaOH=Na2SO3+H2O。
⑴①装置是制取SO2的,所以①中发生反应的化学方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑。
(2)SO2是酸性氧化物,溶于水生成亚硫酸,溶液显酸性,因此实验现象是试液变为红色。
(3)SO2还具有漂白性,能使品红溶液褪色。
(4)SO2中S元素的化合价处于中间价态,既有氧化性,还有还原性。由于H2S具有还原性,能被SO2氧化生成单质S,所以实验现象是产生淡黄色沉淀。
(5)溴水具有氧化性,能把SO2氧化生成硫酸,所以实验现象是溴水褪色。
(6)SO2是大气污染物,不能排放在大气中,所以⑥的作用是吸收吸收尾气,防止污染空气,反应的方程式是SO2+2NaOH=Na2SO3+H2O。

练习册系列答案
相关题目
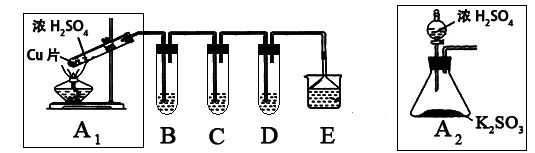
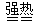 Fe2O3+SO2↑+ SO3↑+ 14H2O,将生成的气体通入BaCl2溶液中,下列叙述中正确的是
Fe2O3+SO2↑+ SO3↑+ 14H2O,将生成的气体通入BaCl2溶液中,下列叙述中正确的是