题目内容
根据元素在周期表中位置判断,下列叙述正确的是
A.金属性强弱:Rb>Ca>Al B.阴离子还原性:O2->S2->Se2-
C.氢化物的稳定性: PH3>H2S>HCl D.酸性强弱:H2SO4>H3PO4>HClO4
A

练习册系列答案
相关题目
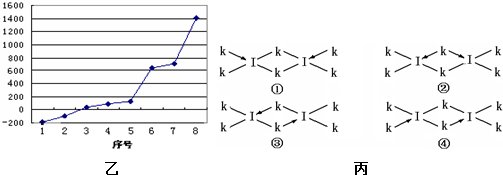
(1)已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ/mol)如下表所示:
①三种元素在周期表中位于第 周期
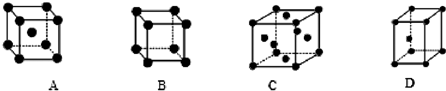
②X晶体采用的堆积方式是下列中 (填字母)
(2)已知N-N、N=N、N≡N键能之比为1.00:2.17:4.90,而C-C、C=C、C≡C键能之比为1.00:1.77:2.34,由此你得出的结论是 .
(3)N2O的等电子体为:①分子 ,②阴离子 ;由此可知N2O的中心原子的杂化类型为 .根据价层电子对互斥模型确定NO2的分子构型为 .
(4)已知铜能形成多种化合物,如硫酸铜的结构如下图所示,请在图中标出水合铜离子中的配位键.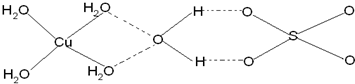
| X | Y | Z | |
| I1 | 496 | 738 | 577 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2754 |
| I4 | 9540 | 10540 | 11578 |
②X晶体采用的堆积方式是下列中

(2)已知N-N、N=N、N≡N键能之比为1.00:2.17:4.90,而C-C、C=C、C≡C键能之比为1.00:1.77:2.34,由此你得出的结论是
(3)N2O的等电子体为:①分子
(4)已知铜能形成多种化合物,如硫酸铜的结构如下图所示,请在图中标出水合铜离子中的配位键.

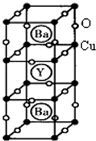 (物质结构与性质)新型节能材料高温超导体的最先突破是在1987年从新的钇钡铜氧材料的研究开始的.在制备钇钡铜氧高温超导体的同时,偶然得到了副产品--紫色的硅酸铜钡.凑巧的是,后者正是发现于中汗代器物上的被称为“汗紫”的颜料,还发现于秦俑彩绘.
(物质结构与性质)新型节能材料高温超导体的最先突破是在1987年从新的钇钡铜氧材料的研究开始的.在制备钇钡铜氧高温超导体的同时,偶然得到了副产品--紫色的硅酸铜钡.凑巧的是,后者正是发现于中汗代器物上的被称为“汗紫”的颜料,还发现于秦俑彩绘. 位于元素周期表前四周期的五种元素A、B、C、D、E,原子序数依次增大.A元素原子的最外层电子排布可表示为:asaap2a,B元素在地壳中含量居第二位,C与B位于同一周期,且是该周期元素中电负性最大的元素,D元素的+3价离子的3d亚层为半充满,E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子.
位于元素周期表前四周期的五种元素A、B、C、D、E,原子序数依次增大.A元素原子的最外层电子排布可表示为:asaap2a,B元素在地壳中含量居第二位,C与B位于同一周期,且是该周期元素中电负性最大的元素,D元素的+3价离子的3d亚层为半充满,E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子.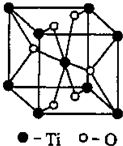 [化学-物质结构与性质]
[化学-物质结构与性质]