题目内容
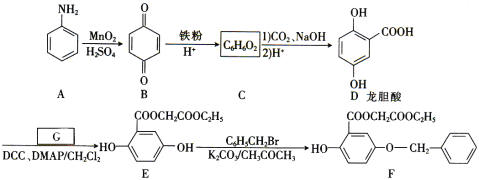
【题目】氮族元素单质及其化合物有着广泛应用。
![]() 在
在![]() 密闭容器中放入
密闭容器中放入![]()
![]() ,一定温度进行如下反应
,一定温度进行如下反应![]()
反应时间![]() 与容器内气体总压强
与容器内气体总压强![]() 的数据见下表:
的数据见下表:
时间 温度 | 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| -- | -- | -- |
|
|
回答下列问题:
![]() 的电子式为______。
的电子式为______。
![]() 温度下,反应平衡常数
温度下,反应平衡常数![]() ______。
______。
![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() ,
,![]() 的平衡转化率
的平衡转化率![]() ______
______![]() 。
。
![]() 在一定条件下发生如下分解:
在一定条件下发生如下分解:![]() 在温度和容积不变的条件下,能说明该反应已达到平衡状态的是______
在温度和容积不变的条件下,能说明该反应已达到平衡状态的是______![]() 填字母序号
填字母序号。
a.n(N2O)=n(NO2) b.容器内压强保持不变 c.υ正(N2O)=υ正(NO2) d.气体颜色保持不变
【答案】![]()
![]() < < b、d
< < b、d
【解析】
(1) ① P原子最外层有5个电子,Cl原子最外层有7个电子,P原子与3个Cl原子形成3对共用电子对,PCl3的电子式为![]() ;
;
②相同条件下压强之比等于物质的量之比,T1反应达到平衡时气体的总物质的量为9×0.1mol÷5=0.18mol,
PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
开始(mol/L) 0.1 0 0
转化(mol/L) x x x
平衡(mol/L) 0.1-x x x
0.1-x+x+x=0.18,计算得出x=0.08;K=0.08×0.08÷(0.1-0.08)=0.32;
③体积、物质的量不变,则压强与温度成正比,由表中数据可以知道, T1<T2;T2达到平衡时气体总物质的量为11×0.1mol÷6=0.183mol>0.18mol,升高温度平衡正向移动,可以知道PCl5的平衡转化率α1(T1) <α2(T2);
(2)a. 根据转化之比等于化学计量数之比n(N2O)恒等于n(NO2),n(N2O)=n(NO2)不能说明该反应已达到平衡状态;
b.该反应为气体体积减小的反应,因此当容器内压强保持不变时,反应达到平衡状态;
c. υ正(N2O)=υ逆(NO2),表明正逆反应速率,且满足速率之比和化学计量数成正比时,才可以判定反应已达到平衡状态,但题中只有正反应速率,不能说明反应达到平衡状态;
d. 气体颜色保持不变,也就是有色气体的浓度不发生变化,反应达到平衡状态;
综上所述,本题选bd 。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案