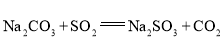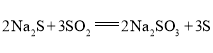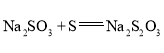题目内容
【题目】某(NH4)2CO3和(NH4)2SO4的固体混合物含氮量为23.3%。
(1)取9.0g该混合物,加入足量浓NaOH溶液,加热,产生的气体在标准状况下体积为________________L(保留2位小数)。
(2)向上述反应后的混合溶液中再加入足量稀盐酸,产生560mL气体(标准状况)。列式计算原固体混合物中(NH4)2CO3和(NH4)2SO4的物质的量之比。________________
【答案】3.36 1:2
【解析】
(1)根据N原子守恒计算;
(2)先根据二氧化碳的体积算出(NH4)2CO3的物质的量,再算出(NH4)2SO4的物质的量。
(1)根据N原子守恒,V(NH3)=n(NH3)×22.4L·mol-1=![]() mol×22.4L·mol-1=3.36L;故答案为:3.36L;
mol×22.4L·mol-1=3.36L;故答案为:3.36L;
(2)n[(NH4)2CO3]=n(CO2)=![]() =0.025mol,9.0g (NH4)2CO3和(NH4)2SO4的固体混合物中n[(NH4)2SO4]=
=0.025mol,9.0g (NH4)2CO3和(NH4)2SO4的固体混合物中n[(NH4)2SO4]=![]() =0.05mol,原固体混合物中(NH4)2CO3和(NH4)2SO4的物质的量之比0.025mol:0.05mol=1:2,故答案为:1:2。
=0.05mol,原固体混合物中(NH4)2CO3和(NH4)2SO4的物质的量之比0.025mol:0.05mol=1:2,故答案为:1:2。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
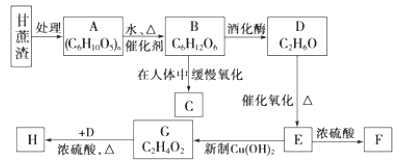
黄冈创优卷系列答案【题目】![]() 是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和
是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和![]() 。某小组设计了如下实验装置制备
。某小组设计了如下实验装置制备![]() (夹持及加热仪器略),总反应为
(夹持及加热仪器略),总反应为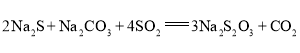 。回答下列问题:
。回答下列问题:
a.![]() b.
b.![]() 粉末 c.
粉末 c.![]() 溶液 d.
溶液 d.![]() 、
、![]() 溶液 e.
溶液 e. ![]() 溶液
溶液
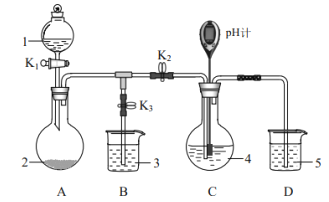
(1)装置A的作用是制备________,反应的化学方程式为________。
(2)完成下表实验过程:
操作步骤 | 装置C的实验现象 | 解释原因 |
检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以 |
打开 | ⅰ.导管口有气泡冒出,② ___ ⅱ. pH计读数逐渐③___ | 反应分步进行:
|
当pH计读数接近7时,立即停止通 | 必须立即停止通 |
(3)![]() 有还原性,可作脱氯剂。向
有还原性,可作脱氯剂。向![]() 溶液中通入少量
溶液中通入少量![]() ,某同学预测
,某同学预测![]() 转变为
转变为![]() ,设计实验验证该预测:取少量反应后的溶液于试管中,________。
,设计实验验证该预测:取少量反应后的溶液于试管中,________。