题目内容
(10分)
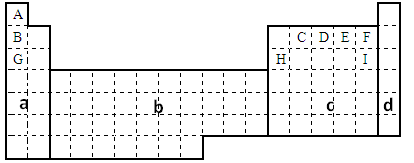
(1)在上面元素周期表中全部是金属元素的区域为___________。
(2)G元素单质在E元素单质中燃烧时形成的化合物的化学式是______,它是__________(填“共价化合物”或“离子化合物”)。该化合物含有的化学键类型是 ;
该化合物的电子式是 。
(3)表格中九种元素能形成最高价氧化物对应的水化物中,碱性最强的是________(用化合物的化学式表示,下同),酸性最强的是__________,属于两性氢氧化物的是__________。
(4)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是 ________(填名称),可以验证该结论的实验是_______。(填编号)
a将在空气中放置已久的这两种元素的块状单质分别放入热水中;
b将这两种元素的单质粉末分别和同浓度的盐酸反应;
c将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液;
d比较这两种元素的气态氢化物的稳定性。

(1)在上面元素周期表中全部是金属元素的区域为___________。
| A.a | B.b | C.c | D.d |
该化合物的电子式是 。
(3)表格中九种元素能形成最高价氧化物对应的水化物中,碱性最强的是________(用化合物的化学式表示,下同),酸性最强的是__________,属于两性氢氧化物的是__________。
(4)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是 ________(填名称),可以验证该结论的实验是_______。(填编号)
a将在空气中放置已久的这两种元素的块状单质分别放入热水中;
b将这两种元素的单质粉末分别和同浓度的盐酸反应;
c将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液;
d比较这两种元素的气态氢化物的稳定性。
(1)B(1分)
(2) Na2O2,离子化合物离子键和非极性键(或共价键); (3分)
(3分)
(3) NaOH, HClO4, Al(OH)3。(3分) (4) ①(1分)② 镁, (1分) bc。(1分)
(2) Na2O2,离子化合物离子键和非极性键(或共价键);
 (3分)
(3分)(3) NaOH, HClO4, Al(OH)3。(3分) (4) ①(1分)② 镁, (1分) bc。(1分)
考查元素周期表的结构及元素周期律的应用。根据元素在周期表中的位置可知A~I分别是H、Li、C、N、O、F、Na、Al、Cl。
(1)过渡元素全部属于金属元素,所以答案选B。
(2)钠在氧气的燃烧产物是过氧化钠,含有离子键和非极性键,电子式为 。
。
(3)金属性越强,最高价氧化物的水化物的碱性越强;非金属性越强,最高价氧化物的水化物的酸性越强,所以氢氧化钠的碱性最强,HClO4的酸性最强,Al(OH)3属于两性氢氧化物。
(4)常温下在浓硫酸中发生钝化的短周期元素是铝,则甲是铝,位于第三周期第ⅢA。乙元素原子核外M电子层与K电子层上的电子数相等,所以乙是镁,位于第三周期第ⅡA。同周期自左向右金属性逐渐增强,所以金属性强的是镁。比较元素金属性强弱的依据
1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强。
2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强。
3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强
4.依据金属单质与盐溶液之间的置换反应。一般是活泼金属置换不活泼金属。但是ⅠA族和ⅡA族的金属在与盐溶液反应时,通常是先与水反应生成对应的强碱和氢气,然后强碱再可能与盐发生复分解反应。
5.依据金属活动性顺序表(极少数例外)。
6.依据元素周期表。同周期中,从左向右,随着核电荷数的增加,金属性逐渐减弱;同主族中,由上而下,随着核电荷数的增加,金属性逐渐增强。
7.依据原电池中的电极名称。做负极材料的金属性强于做正极材料的金属性。
所以据此可知选项bc正确。
(1)过渡元素全部属于金属元素,所以答案选B。
(2)钠在氧气的燃烧产物是过氧化钠,含有离子键和非极性键,电子式为
 。
。(3)金属性越强,最高价氧化物的水化物的碱性越强;非金属性越强,最高价氧化物的水化物的酸性越强,所以氢氧化钠的碱性最强,HClO4的酸性最强,Al(OH)3属于两性氢氧化物。
(4)常温下在浓硫酸中发生钝化的短周期元素是铝,则甲是铝,位于第三周期第ⅢA。乙元素原子核外M电子层与K电子层上的电子数相等,所以乙是镁,位于第三周期第ⅡA。同周期自左向右金属性逐渐增强,所以金属性强的是镁。比较元素金属性强弱的依据
1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强。
2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强。
3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强
4.依据金属单质与盐溶液之间的置换反应。一般是活泼金属置换不活泼金属。但是ⅠA族和ⅡA族的金属在与盐溶液反应时,通常是先与水反应生成对应的强碱和氢气,然后强碱再可能与盐发生复分解反应。
5.依据金属活动性顺序表(极少数例外)。
6.依据元素周期表。同周期中,从左向右,随着核电荷数的增加,金属性逐渐减弱;同主族中,由上而下,随着核电荷数的增加,金属性逐渐增强。
7.依据原电池中的电极名称。做负极材料的金属性强于做正极材料的金属性。
所以据此可知选项bc正确。

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
 >
>
 ,b与c形成的化合物的电子式为
,b与c形成的化合物的电子式为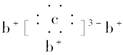 。下列说法中正确的是( )
。下列说法中正确的是( )