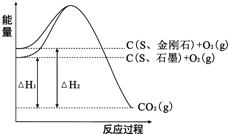
题目内容
【题目】下列各项表述正确的是
A.已知H2燃烧热△H为-285.8kJ/mol,则:2H2(g)+O2(g) ==2H2O(g) △H=-571.6kJ/mol
B.已知稀盐酸与NaOH稀溶液反应的中和热△H为-57.3kJ/mol,则:H2SO4(aq)+2NaOH(aq) ==Na2SO4(aq)+2H2O(l) △H=-57.3kJ/mol
C.电解稀硫酸可能发生反应:Cu+H2SO4![]() CuSO4+H2↑
CuSO4+H2↑
D.以石墨为电极电解MgCl2溶液的总离子方程式:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
【答案】C
【解析】
试题分析:A.水在液体时是稳定状态,,故A错误;B.中和热△H为-57.3kJ/mol,则:H2SO4(aq)+2NaOH(aq) ==Na2SO4(aq)+2H2O(l) △H=2×(-57.3)kJ/mol,故B错误;C.用铜作阳极,电解稀硫酸可能发生反应:Cu+H2SO4![]() CuSO4+H2↑,故C正确;D.电解生成的氢氧根离子要与镁离子反应生成氢氧化镁沉淀,故D错误;故选C。
CuSO4+H2↑,故C正确;D.电解生成的氢氧根离子要与镁离子反应生成氢氧化镁沉淀,故D错误;故选C。

练习册系列答案
相关题目