题目内容
【题目】(多选)常温下,向 20mL 0.1molL﹣1 NH4HSO4溶液中滴加 0.1molL﹣1 Ba(OH)2 溶液,溶液 pH 与 Ba(OH)2溶液体积的关系曲线如图所示.已知NH3H20的电离常数Kb(NH3H20)=1.75×10﹣5 . 下列有关分析正确的是( ) 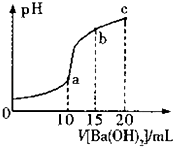
A.a点时溶液的pH=7
B.c点时的溶质是(NH3H2O)
C.b点时溶液中c(NH4+)>c(NH3H2O)
D.a~c段参与反应的离子有H+、OH﹣、Ba2+、SO42﹣
【答案】BC
【解析】解:A.a点时,n(NH4HSO4)=2n[Ba(OH)2],该点溶液中发生的反应为2NH4HSO4+Ba(OH)2=BaSO4↓+(NH4)2SO4+2H2O,该点溶液中溶质为 (NH4)2SO4 , (NH4)2SO4是强酸弱碱盐,铵根离子水解导致溶液呈酸性,溶液的pH<7,故A错误;B.c点时,n(NH4HSO4)=n[Ba(OH)2],该点溶液中发生的反应为NH4HSO4+Ba(OH)2=BaSO4↓+NH3 . H2O+H2O,溶液中的溶质为NH3 . H2O,故B正确;
C.b点时,3n(NH4HSO4)=4n[Ba(OH)2],该点溶液中发生的反应为4NH4HSO4+3Ba(OH)2=3BaSO4↓+2NH3 . H2O+(NH4)2SO4+4H2O,溶液中溶质为NH3 . H2O、(NH4)2SO4 , 且二者的物质的量之比为2:1,因为一水合氨的电离程度大于铵根离子水解程度,导致b点时溶液中c(NH4+)>c(NH3H2O),故C正确;
D.b点发生的反应为4NH4HSO4+3Ba(OH)2=3BaSO4↓+2NH3 . H2O+(NH4)2SO4+4H2O、c点发生的反应为NH4HSO4+Ba(OH)2=BaSO4↓+NH3 . H2O+H2O,所以a~c段参与反应的离子还有NH4+ , 故D错误;
故选BC.

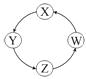
【题目】下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有( )
序号 | X | Y | Z | W |
|
① | Cu | CuSO4 | Cu(OH)2 | CuO | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.①②③
B.①③④
C.②③
D.①④
【题目】卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多氯代甲烷常为有机溶剂,其分子结构为正四面体的名称为;碳原子个数不大于10的烷烃分子中,其一氯代物只有一种的烷烃的个数为个.
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构式(不考虑立体异构).
(3)聚氯乙烯是生活中常用的塑料,工业生产聚氯乙烯的一种工艺路线如下: 乙烯 ![]() 1,2﹣二氯乙烷
1,2﹣二氯乙烷 ![]() 氯乙烯
氯乙烯 ![]() 聚氯乙烯
聚氯乙烯
反应①的反应类型为;
反应②的反应类型为 .
(4)实验室以乙醇、浓硫酸和溴化钠为试剂,用如图的装置制备溴乙烷,图中省去了加热装置. 
有关数据见表:
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红棕色液体 |
密度(g/cm3) | 0.79 | 1.44 | 3.1 |
沸点 | 78.5 | 38.4 | 59 |
①仪器B名称是 , 仪器B的作用是 .
②制备过程中,加入的浓硫酸必须进行稀释,其目的是(填序号)
A.减少副产物烯和醚的生成 B.减少Br2的生成 C.水是反应的催化剂 D.硫酸的浓度越稀反应越快
③加热应采取的方式为;加热的目的是 .
④为除去收集产品中的主要杂质,应选取加入的合理试剂为;采用的操作是 .