题目内容
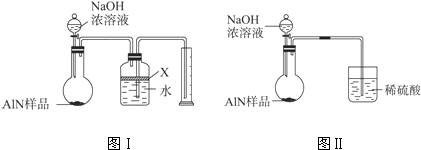
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某氮化铝样品中可能含有碳或氧化铝中的一种杂质,现用图Ⅰ所示的装置来进行检验,使氮化铝样品和NaOH溶液反应AlN+NaOH+H2O====NaAlO2+NH3↑,已知NH3极易溶解于水,Al在常温下能与NaOH溶液反应:2Al+2NaOH+2H2O====2NaAlO2+3H2↑。根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)。
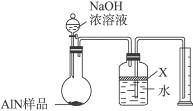
图Ⅰ
(1)实验有关操作为:
a.往圆底烧瓶中放入AlN样品w g,并向广口瓶中加入水和X液体
b.从分液漏斗往圆底烧瓶中加入一定体积的过量的浓NaOH溶液
c.检验装置的气密性
d.读取收集到水的体积
正确的操作顺序为______________________。
(2)本实验中检查装置气密性的方法是________________________。
(3)广口瓶中的试剂X可选用___________(填选项的标号)。
A.丁烷 B.酒精 C.植物油 D.CCl4
(4)实验结束后,若观察到烧瓶中还有固体,则样品中含有的杂质是________________。
(5)实验结束后,分液漏斗中的NaOH溶液已经全部加入烧瓶,量筒中收集到水的体积为a L,若当时的实验条件为标准状况,则样品中的AlN的质量分数为___________(AlN的式量为41),这一测定结果比实际值偏高,你认为可能的原因是__________________________。
(6)有人建议改用图Ⅱ装置进行同样实验,欲通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数。你认为这样的改进是否可行?________________(填“可行”或“不可行”)。理由是________________________。
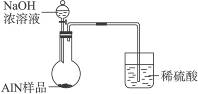
图Ⅱ
(1)c、a、b、d
(2)关闭分液漏斗活塞,在量筒中加适量水浸没导管口,微热圆底烧瓶,量筒中产生气泡,恢复到室温时导管中形成一段液柱
(3)C (4)碳
(5)![]() ×100% 加入的过量氢氧化钠溶液占有一定的体积,使排出的水的体积偏大
×100% 加入的过量氢氧化钠溶液占有一定的体积,使排出的水的体积偏大
(6)不可行 氨气极易被硫酸吸收,发生倒吸现象
解析:
根据题意,该实验为一定量实验,因此按装置图连接装置后,首先要检验装置的气密性,其方法是:关闭分液漏斗活塞,在量筒中加适量水浸没导管口,使装置密闭,再微热圆底烧瓶,使装置内气体体积膨胀,若量筒中产生气泡,恢复到室温时导管中形成一段水柱,则气密性良好。由于NH3极易溶于水,因此,用NH3排水时,必须用试剂X将NH3与H2O隔开,广口瓶中的试剂X必须具备两个条件:①不与NH3、H2O反应,不溶解NH3,不溶于水;②密度比H2O小。所以试剂X可选用植物油。实验结束后,若烧瓶中还有固体,则样品中含有的杂质是碳,因为AlN和Al2O3能与NaOH溶液反应,溶解于NaOH溶液中。
由AlN+NaOH+H2O====NaAlO2+NH3↑
41 g 22.4 L
![]() a L
a L
得w(AlN)=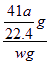 ×100%=
×100%=![]() ×100%
×100%
测定结果比实际值偏高,是因为加入的过量NaOH溶液占有一定的体积,使排出的水的体积偏大,即a值偏大。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案