题目内容
甲、乙、丙、丁、戊是五种短周期元素,其原子序数依次增大,它们可以组成下列框图所有物质.甲与乙、丙与乙均可形成原子个数比为2:1和1:1的化合物,丁元素原子的最外层电子数是其电子层数的2倍,框图中溶液M为黄绿色.在一定条件下,下列各物质可发生如图所示的变化.试回答:(1)戊元素的原子结构示意图为
(2)A的电子式为
(3)工业上由F制备H的条件是
(4)反应(Ⅰ)的离子方程式为 .
(5)反应(Ⅱ)的化学方程式为 .
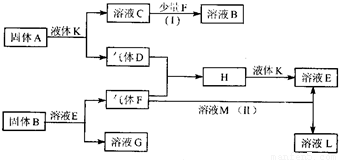
【答案】分析:甲与乙、丙与乙均可形成原子个数比为2:1和1:1的化合物,常见化合物有H2O、H2O2、Na2O、Na2O2等,则甲为H,乙为O,丙为Na,丁元素原子的最外层电子数是其电子层数的2倍,且原子序数大于丙,则应为S,溶液M为黄绿色,应为氯气的水溶液,说明戊应为Cl元素,气体F与M反应生成两种溶液,其中M为氯气,应为SO2和Cl2的反应,生成H2SO4和HCl,则F为SO2,与O2反应最终生成硫酸,则D为O2,H为SO3,E为H2SO4,L为HCl,K应为H2O,固体A与水反应生成O2,应为Na2O2,与水反应还生成NaOH,即C为NaOH,与少量SO2反应生成Na2SO3,固体B应为Na2SO3,G为Na2SO4,结合物质的性质解答该题.
解答:解:甲与乙、丙与乙均可形成原子个数比为2:1和1:1的化合物,常见化合物有H2O、H2O2、Na2O、Na2O2等,则甲为H,乙为O,丙为Na,丁元素原子的最外层电子数是其电子层数的2倍,且原子序数大于丙,则应为S,溶液M为黄绿色,应为氯气的水溶液,说明戊应为Cl元素,气体F与M反应生成两种溶液,其中M为氯气,应为SO2和Cl2的反应,生成H2SO4和HCl,则F为SO2,与O2反应最终生成硫酸,则D为O2,H为SO3,E为H2SO4,L为HCl,K应为H2O,固体A与水反应生成O2,应为Na2O2,与水反应还生成NaOH,即C为NaOH,与少量SO2反应生成Na2SO3,固体B应为Na2SO3,G为Na2SO4,则
(1)戊为Cl元素,原子核外有3个电子层,最外层电子数为7,原子结构示意图为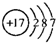 ,故答案为:
,故答案为: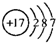 ;
;
(2)A为Na2O2,为离子化合物,电子式为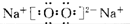 ,故答案为:
,故答案为: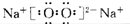 ;
;
(3)工业由SO2制备SO3,在常压下、500℃以及为催化剂的条件下反应,
故答案为:常压、催化剂(或V2O5)、500℃左右(高温);
(4)C为NaOH,与少量SO2反应生成Na2SO3,反应的离子方程式为2OH-+SO2═SO32-+H2O,
故答案为:2OH-+SO2═SO32-+H2O;
(5)SO2和Cl2的反应,生成H2SO4和HCl,反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl.
点评:本题考查元素化合物推断,题目难度较大,解答本题时注意把握原子的结构特点以及对应单质、化合物的相关性质,根据反应的典型现象和反应关系作为突破口进行推断.
解答:解:甲与乙、丙与乙均可形成原子个数比为2:1和1:1的化合物,常见化合物有H2O、H2O2、Na2O、Na2O2等,则甲为H,乙为O,丙为Na,丁元素原子的最外层电子数是其电子层数的2倍,且原子序数大于丙,则应为S,溶液M为黄绿色,应为氯气的水溶液,说明戊应为Cl元素,气体F与M反应生成两种溶液,其中M为氯气,应为SO2和Cl2的反应,生成H2SO4和HCl,则F为SO2,与O2反应最终生成硫酸,则D为O2,H为SO3,E为H2SO4,L为HCl,K应为H2O,固体A与水反应生成O2,应为Na2O2,与水反应还生成NaOH,即C为NaOH,与少量SO2反应生成Na2SO3,固体B应为Na2SO3,G为Na2SO4,则
(1)戊为Cl元素,原子核外有3个电子层,最外层电子数为7,原子结构示意图为
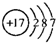 ,故答案为:
,故答案为: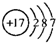 ;
;(2)A为Na2O2,为离子化合物,电子式为
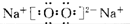 ,故答案为:
,故答案为: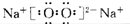 ;
;(3)工业由SO2制备SO3,在常压下、500℃以及为催化剂的条件下反应,
故答案为:常压、催化剂(或V2O5)、500℃左右(高温);
(4)C为NaOH,与少量SO2反应生成Na2SO3,反应的离子方程式为2OH-+SO2═SO32-+H2O,
故答案为:2OH-+SO2═SO32-+H2O;
(5)SO2和Cl2的反应,生成H2SO4和HCl,反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl.
点评:本题考查元素化合物推断,题目难度较大,解答本题时注意把握原子的结构特点以及对应单质、化合物的相关性质,根据反应的典型现象和反应关系作为突破口进行推断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或 三种元素组成的化合物,辛是由C元素形成的单质.已知:甲+乙=丁+辛,甲+丙=戊+辛;常温下0.1mol/L 丁溶液的pH为13.下列说法正确的是( )
| A、元素B在周期表中的位置为第二周期第VIA族 | B、元素B、C、D的原子半径由大到小的顺序为r(D)>r(C)>r(B) | C、1.0 L0.1 mol/L戊溶液中阴离子总的物质的量小于0.1 mol | D、1 mol甲与足量的乙完全反应共转移了约6.02×1O23个电子 |
 甲、乙、丙、丁、戊是中学化学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条中和部分产物已略去).
甲、乙、丙、丁、戊是中学化学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条中和部分产物已略去). 甲、乙、丙、丁、戊是五种短周期元素,其原子序数依次增大,它们可以组成下列框图所有物质.甲与乙、丙与乙均可形成原子个数比为2:1和1:1的化合物,丁元素原子的最外层电子数是其电子层数的2倍,框图中溶液M为黄绿色.在一定条件下,下列各物质可发生如图所示的变化.试回答:
甲、乙、丙、丁、戊是五种短周期元素,其原子序数依次增大,它们可以组成下列框图所有物质.甲与乙、丙与乙均可形成原子个数比为2:1和1:1的化合物,丁元素原子的最外层电子数是其电子层数的2倍,框图中溶液M为黄绿色.在一定条件下,下列各物质可发生如图所示的变化.试回答:

