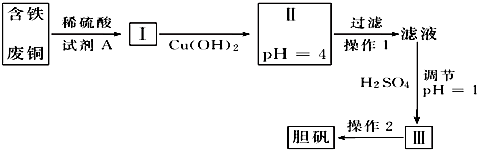
题目内容
为使反应:Cu+2H2O═Cu(OH)2+H2↑能够发生,下列设计方案正确的是( )
分析:A、原电池反应是自发进行的氧化还原反应;
B、铜片做电极电解硫酸铜溶液是电镀;
C、铜片做阳极电解硫酸钠溶液铜和水反应生成氢氧化铜和氢气;
D、铜做电极,电解硫酸溶液是铜和硫酸的反应生成硫酸铜和氢气.
B、铜片做电极电解硫酸铜溶液是电镀;
C、铜片做阳极电解硫酸钠溶液铜和水反应生成氢氧化铜和氢气;
D、铜做电极,电解硫酸溶液是铜和硫酸的反应生成硫酸铜和氢气.
解答:解:A、用铜片做负极,石墨电极作正极,氯化钠溶液为电解质溶液,不能发生铜和水的反应,故A错误;
B、用铜片做电极,外接直流电源电解硫酸铜溶液是阴极镀铜,不符合要求的反应,故B错误;
C、用铜片作阳极,铁片作阴极,电解硫酸钠溶液,阳极电极反应为Cu-2e-=Cu2+,阴极电极反应为2H++2e-=H2↑,电池反应为Cu+2H2O═Cu(OH)2+H2↑,故C正确;
D、用铜片作阴、阳电极,电解稀硫酸,发生的反应是,Cu+2H+=Cu2++H2↑,故D错误;
故选C.
B、用铜片做电极,外接直流电源电解硫酸铜溶液是阴极镀铜,不符合要求的反应,故B错误;
C、用铜片作阳极,铁片作阴极,电解硫酸钠溶液,阳极电极反应为Cu-2e-=Cu2+,阴极电极反应为2H++2e-=H2↑,电池反应为Cu+2H2O═Cu(OH)2+H2↑,故C正确;
D、用铜片作阴、阳电极,电解稀硫酸,发生的反应是,Cu+2H+=Cu2++H2↑,故D错误;
故选C.
点评:本题考查了电解原理的应用,主要是电极判断和电极反应的分析应用,题目较简单.

练习册系列答案
相关题目


 Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解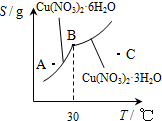
 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,Cu与液态N2O4反应制得无水硝酸铜的化学方程式是
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,Cu与液态N2O4反应制得无水硝酸铜的化学方程式是