题目内容
7.某有机物由C、H、O三种元素组成,它的红外吸收光谱表明有羟基O-H键和烃基上C-H键的红外吸收光峰,且烃基与羟基上氢原子个数之比为2:1,该有机物可能为( )| A. | 乙二醇 | B. | 乙醇 | C. | 甲醇 | D. | 丙三醇 |
分析 根据有羟基O-H键和烃基上C-H键,烃基与羟基上氢原子个数之比为2:1解题.
解答 解:A.乙二醇有羟基O-H键和烃基上C-H键,烃基与羟基上氢原子个数之比为2:1,故A正确;
B.乙醇有羟基O-H键和烃基上C-H键,烃基与羟基上氢原子个数之比为5:1,故B错误;
C.甲醇有羟基O-H键和烃基上C-H键,烃基与羟基上氢原子个数之比为3:1,故C错误;
D.丙三醇有羟基O-H键和烃基上C-H键,烃基与羟基上氢原子个数之比为5:3,故D错误.
故选A.
点评 本题考查有机物分子式与结构式的确定,难度不大,明确物质的结构是解题的关键.

练习册系列答案
相关题目
17.向200mL 18mol/L H2SO4溶液中加入足量的铜片,加热使之反应,则充分反应后,被还原的H2SO4的物质的量可能是( )
| A. | 1.5mol | B. | 1.81mol | C. | 2.5mol | D. | 3.6mol |
18.下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是( )
| A. | K+ MnO4- Cl- SO42- | B. | Na+ AlO2- Cl- SO42- | ||
| C. | SO42-Na+ HCO3-Ba2+ | D. | Na+ NO3- NH4+ SO42- |
15.A、B、C、D为四种短周期元素,已知A、C同主族,B、D同周期,A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;若B的阳离子比C的阴离子少一个电子层,下列叙述正确的是( )
| A. | 原子序数:A>B>D>C | B. | 金属性B>D,非金属性A>C | ||
| C. | 原子半径:D>B>C>A | D. | 简单离子半径:C>B>D>A |
2.下列各变化中属于原电池反应的是( )
| A. | 在空气中金属铝表面迅速氧化形成保护层 | |
| B. | 锌与稀硫酸反应时,加入少量NaHSO4固体时,可使反应速率加快 | |
| C. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 | |
| D. | 镀锌铁表面有划损时,仍然能阻止铁被氧化 |
12.对如图装置的叙述错误的是( )
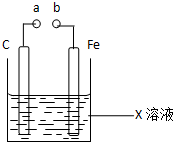

| A. | X如果是Fe2(SO4)3,则不论a和b是否用导线连接成通路,铁片均发生氧化反应 | |
| B. | X如果是CuSO4,a和b分别连接直流电源正、负极,一段时间后铁片质量增加 | |
| C. | X如果是HCl,则不论a和b用导线连接还是a和b分别连接直流电源的正、负极时,H+的移动方向均相同 | |
| D. | X如果是NaCl,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程 |
19.随着碱金属、卤素原子半径的增大,下列递变规律正确的是( )
| A. | 碱金属和卤素单质的熔沸点都逐渐降低 | |
| B. | 碱金属和卤素单质的密度都依次变大 | |
| C. | 卤素的气态氢化物稳定性逐渐增强 | |
| D. | 碱金属单质还原性逐渐增强 |
13.空气是人类生存所必需的重要资源,下列说法正确的是( )
| A. | 2009年11月,中国政府公布了温室气体减排的行动目标,减排气体是的指二氧化硫 | |
| B. | 氮氧化物排放会引起光化学污染而与酸雨无关 | |
| C. | 开发新能源、燃煤脱硫、安装汽车尾气转化器等措施可以减少酸雨 | |
| D. | 二氧化碳是无毒的气体,可以任意排放 |
 HClO:
HClO:
 Na2O2:
Na2O2: .
.