题目内容
【题目】工业上用生锈的Fe粉和Cu粉的混合物制备CuSO45H2O和FeSO4(NH4)2SO46H2O的工艺流程如图1所示.
已知:①几种物质的溶解度(g/100gH2O)如表所示.
FeSO47H2O | (NH4)2SO4 | FeSO4(NH4)2SO46H2O | |
20℃ | 48 | 75 | 37 |
60℃ | 101 | 88 | 38 |
②溶液pH>4时,Fe2+容易被氧化.
请回答:
(1)过滤所用的主要玻璃仪器为 .
(2)溶液1中的主要溶质为(填化学式).
(3)进行操作2时,从溶液中析出晶体后,需趁热过滤,原因为 .
(4)FeSO4(NH4)2SO46H2O用适量稀硫酸洗涤,而不是用水洗涤的原因为 .
(5)称取2.50gCuSO45H2O样品,灼烧过程中样品质量随温度(T)变化的曲线如图2所示. 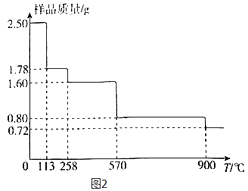
①120℃所的固体,继续加热至258℃时失水,所发生反应的化学方程式为 .
②900℃时剩余固体只有一种铜的氧化物,其化学式为 .
【答案】
(1)玻璃棒、漏斗、烧杯
(2)FeSO4、H2SO4
(3)减小硫酸亚铁和硫酸铵的析出使得FeSO4?(NH4)2SO4?6H2O晶体更纯
(4)抑制亚铁离子和铵根离子的水解,防止亚铁离子被氧化
(5)CuSO4?H2O ![]() CuSO4+H2O;Cu2O
CuSO4+H2O;Cu2O
【解析】解:流程分析可知生锈的Fe粉和Cu粉的混合物,加入足量和稀硫酸得硫酸亚铁溶液及铜固体,过滤得滤渣1为铜,滤液1为硫酸亚铁和稀硫酸混合溶液,在铜中再加硫酸同时通入氧气氧化铜得硫酸铜溶液,经蒸浓缩、降温结晶可得硫酸晶体,滤液1经调节PH值,再加入硫酸铵,经蒸发浓缩,趁热过滤可得FeSO4(NH4)2SO46H2O晶体,同时可减小硫酸亚铁和硫酸铵的析出使得FeSO4(NH4)2SO46H2O晶体更纯,再经适量稀硫酸洗涤干燥得较纯的FeSO4(NH4)2SO46H2O晶体,(1)过滤所用的主要玻璃仪器为玻璃棒、漏斗、烧杯,所以答案是:;(2)根据上面分析可知,溶液1中的主要溶质为FeSO4、H2SO4 ,
所以答案是:FeSO4、H2SO4;(3)根据题中提供的溶解度数据可知,进行操作2时,从溶液中析出晶体后,需趁热过滤,原因为减小硫酸亚铁和硫酸铵的析出使得FeSO4(NH4)2SO46H2O晶体更纯,
所以答案是:减小硫酸亚铁和硫酸铵的析出使得FeSO4(NH4)2SO46H2O晶体更纯;(4)FeSO4(NH4)2SO46H2O用适量稀硫酸洗涤,抑制亚铁离子和铵根离子的水解,防止亚铁离子被氧化,
所以答案是:抑制亚铁离子和铵根离子的水解,防止亚铁离子被氧化;(5)①设 CuSO45H2O分解的方程式为
CuSO45H2O |
| CuSO4(5﹣x)H2O+ | xH2O |
250 | 18x | ||
2.5 | 2.5﹣1.78 |
解得x=4,对应固体的化学式为CuSO4H2O,同理可推知,1.60g对应固体的化学式为CuSO4 , 所以发生反应的化学方程式为CuSO4H2O ![]() CuSO4+H2O,
CuSO4+H2O,
所以答案是:CuSO4H2O ![]() CuSO4+H2O;
CuSO4+H2O;
②2.50gCuSO45H2O样品中铜元素的物质的量为0.01mol,根据铜元素守恒可知,900℃时剩余固体只有一种铜的氧化物中铜元素也为0.01mol,而此时固体的质量为0.72g,所以氧化物中氧元素的物质的量为 ![]() mol=0.005mol,所以该铜的氧化物的化学式为 Cu2O,
mol=0.005mol,所以该铜的氧化物的化学式为 Cu2O,
故答案:Cu2O.

【题目】过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域.用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素.反应的方程式为:CO(NH2)2+H2O2 ![]() CO(NH2)2H2O2 . 过氧化尿素的部分性质如下:
CO(NH2)2H2O2 . 过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程(如图1)及反应装置图2:
请回答下列问题:
(1)仪器X的名称是;冷凝管中冷却水从(填“a”或“b”)口进入;
(2)反应器的加热方式是 .
(3)搅拌器是否可用铁质材料(填“是”或“否”),原因是;
(4)步骤①采用减压蒸发的原因是 .
(5)母液可以循环使用提高原料利用率,若欲从母液中分离出H2O2和尿素,可采用的操作是 .
A.盐析、过滤
B.减压蒸馏、结晶
C.分液、过滤
D.常压蒸馏、萃取
(6)准确称取0.5000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL 6molL﹣1 H2SO4 , 用0.1000molL﹣1 KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2H2O2的质量分数为;若滴定前滴定管尖嘴处有气泡,滴定后消失,则测得的过氧化尿素含量(填“偏高”、“偏低”或“不变”).


