��Ŀ����
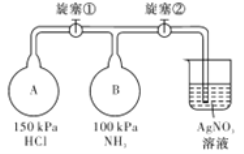
����Ŀ��Һ��ȼ�ϵ�����������ȼ�ϵ�ؾ������С����������洢װ�õ��ŵ㡣һ������(N2H4)Ϊȼ�ϵĵ��װ����ͼ��ʾ���õ���ÿ����е�������Ϊ��������KOH��Ϊ����ʡ����й��ڸ�ȼ�ϵ�ص���������ȷ����( )

A. �������Ҳ�缫�������غ��������缫
B. ���������ĵ缫��ӦʽΪN2H4��4OH����4e��===N2����4H2O
C. ��ȼ�ϵ�صĵ缫����Ӧ���ö������ϣ�����ߵ缫��Ӧ�����ڵ缫���������������ʹ������������Һ��ֽӴ�
D. ��ȼ�ϵ�س����ŵ�ʱ��K���Ӹ���������Ǩ�ƣ�������ӽ���Ĥ��ѡ�������ӽ���Ĥ
���𰸡�D
��������A����ȼ�ϵ���У��Ҳ�ͨ�������������ĵ缫bΪ�������������������������������Ҳ�缫�������غ��������缫����A��ȷ��B��ͨ��ȼ�ϵĵ缫Ϊ������������ȼ��ʧ���ӷ���������Ӧ���缫��ӦʽΪ��N2H4+4OH--4e-=N2��+4H2O����B��ȷ��C����Ϊ�������������Ϊ�������ķ�Ӧ�����Բ��ö������ϣ�������ߵ缫��Ӧ�����ڵ缫���������������ʹ������������Һ��ֽӴ�����C��ȷ��D����ԭ����У��������������������ӣ��������ӽ���ĤҪѡȡ�����ӽ���Ĥ����D����ѡD��

 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д�����Ŀ��ij������ȤС�����ⶨijNaOH��Һ��Ũ�ȣ�������������£��ٽ���ʽ�ζ���������ˮϴ�����ô�����Һ��ϴ����ע�������Һ�����ڵζ��ܵļ��첿�ֳ�����Һ����ʹҺ�洦�ڡ�0���̶����µ�λ�ã����¶���������ƿ������ˮϴ�����ô�����Һ��ϴ��ƿ2��3�Σ��Ӽ�ʽ�ζ����з���25.00mL������Һ����ƿ�У�
�ڽ���ʽ�ζ���������ˮϴ��������������ע��0.1000mol/L�����ᣬ���ڵζ��ܵļ��첿�ֳ�����Һ����ʹҺ�洦�ڡ�0���̶����µ�λ�ã����¶�����
������ƿ�е����̪��ָʾ�������еζ����ζ���ָʾ��ǡ�ñ�ɫ����30���Ӳ��仯�����������������ΪV1mL��
���ظ����Ϲ��̣����ڵζ�����������ƿ����5mL������ˮ�����������������ΪV2mL��
�Իش��������⣺
��1����ƿ�е���Һ��ɫ��Ϊɫʱ��ֹͣ�ζ���
��2���ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧ�۲���
A.�ζ�����Һ��ı仯
B.��ƿ����Һ��ɫ�ı仯
��3����С���ڲ�����еĴ����� �� �ɴ���ɵIJⶨ�������ƫ�ߡ�ƫ�ͻ���Ӱ�죩��
��4�������ȱ�ٵIJ�������
��5����ͼ����ij�εζ�ʱ�ĵζ����е�Һ�棬�����ΪmL��
��6������������ݣ�
�ζ����� | ����Һ�����mL�� | �����������mL�� | |
�ζ�ǰ������mL�� | �ζ��������mL�� | ||
��һ�� | 25.00 | 0.50 | 20.40 |
�ڶ��� | 25.00 | 4.00 | 24.10 |
���������ռ���Һ��Ũ��Ϊmol/L��