题目内容
19.下列各组离子在指定溶液中,可能大量共存的是( )| A. | 澄清透明的溶液中:NH${\;}_{4}^{+}$,Na+,HSO${\;}_{3}^{-}$,Cr2O${\;}_{7}^{2-}$ | |
| B. | c(H+)=10-13mol•L-1的溶液中:Cl-,Br-,S2O${\;}_{3}^{2-}$,Na+ | |
| C. | 能使pH试纸变深蓝色的溶液中:K+,Na+,AlO${\;}_{2}^{-}$,HCO${\;}_{3}^{-}$ | |
| D. | 加入Al能放出H2的溶液中:NO${\;}_{3}^{-}$,K+,SO${\;}_{4}^{2-}$,Mg2+ |
分析 A.重铬酸根离子能够以后亚硫酸氢根离子;
B.该溶液为碱性溶液,溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
C.能使pH试纸变深蓝色的溶液为碱性溶液,溶液中存在大量氢氧根离子,碳酸氢根离子与偏铝酸根离子反应生成氢氧化铝沉淀,碳酸氢根离子与氢氧根离子反应;
D.加入Al能放出H2的溶液中存在大量氢离子或氢氧根离子,镁离子与氢氧根离子反应,酸性条件下硝酸根离子与铝反应不会生成氢气.
解答 解:A.HSO3-,Cr2O72-之间发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.c(H+)=10-13mol•L-1的溶液为碱性溶液,溶液中存在大量氢氧根离子,Cl-、Br-、S2O32-、Na+之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.能使pH试纸变深蓝色的溶液中存在大量氢氧根离子,AlO2-、HCO3-之间反应生成氢氧化铝沉淀和碳酸根离子,HCO3-与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.加入Al能放出H2的溶液为酸性或强碱性溶液,Mg2+与氢氧根离子反应,NO3-在酸性条件下具有强氧化性,与铝反应不会生成氢气,在溶液中一定不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
7.将相同的物质的量浓度的某弱酸HX溶液与NaX溶液人等体积混合后,测得混合后溶液中c(Na+)>c (X-),则下列关系错误的是( )
| A. | c (H+)<c (OH-) | B. | c (HX )<c (X-) | ||
| C. | c (X-)+c(HX )=2c (Na+) | D. | c (X-)-c (HX)═2(c( OH-)-c (H+)) |
4.X、Y、Z M.N是原子序数依次增大的五种短周期主族元素.其相关信息如下表所示.
(1)M位于元素周期表第四周期ⅥA族,单质M的氧化性比单质Y的氧化性弱(填“强”或“弱”)
(2)X、Z可形成化合物ZX,ZX的电子式为Na+[:H]-(用元素符号表示),ZX与盐酸反应.每生成1molX2时转移电子的物质的量为1mol
(3)实验室中检验N的简单离子的试剂是稀硝酸和硝酸银溶液,反应的离子方程式为Ag++Cl-=AgCl↓
(4)M的氢化物5.6L(标准状况下)完全燃烧生成气态氧化物后恢复到室温,放出的热量为127.6kJ,该条件下反应的热化学方程式为2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-510.4kJ/mol.
| 元素 | 相关信息 |
| X | 所有元素中原子半径最小的元素 |
| Y | 地壳中含量最多的元素 |
| Z | 短周期中原子半径最大的金属元素 |
| M | 与Y同主族 |
(2)X、Z可形成化合物ZX,ZX的电子式为Na+[:H]-(用元素符号表示),ZX与盐酸反应.每生成1molX2时转移电子的物质的量为1mol
(3)实验室中检验N的简单离子的试剂是稀硝酸和硝酸银溶液,反应的离子方程式为Ag++Cl-=AgCl↓
(4)M的氢化物5.6L(标准状况下)完全燃烧生成气态氧化物后恢复到室温,放出的热量为127.6kJ,该条件下反应的热化学方程式为2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-510.4kJ/mol.
11.取等体积等浓度的氢氧化钠溶液两份,一份密封保存,另一份敞口放置.几天后,用相同浓度的盐酸分别去中和,至溶液中只有NaCl.若第一份用盐酸V1mL,第二份用盐酸为V2,则V1与V2关系正确的是( )
| A. | V1=V2 | B. | V1>V2 | C. | V1<V2 | D. | V1≤V2 |
8.为测定一置于空气中的某硫酸酸化的FeSO4溶液中Fe2+被氧化的百分率,某同学准确量取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0g;再另取同样的FeSO4溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g.
(1)写出反应中涉及的化学方程式(至少3个)
(2)通过计算,填写下表:
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度
(3)计算原溶液中Fe2+被氧化的百分率.
(1)写出反应中涉及的化学方程式(至少3个)
(2)通过计算,填写下表:
| c(H+) | c(SO42-) | c(Fe2+、Fe3+) |
(3)计算原溶液中Fe2+被氧化的百分率.
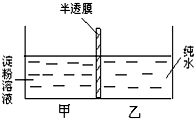 已知如图装置的甲、乙两室内装入液体的体积相同.请回答下列问题:
已知如图装置的甲、乙两室内装入液体的体积相同.请回答下列问题: