题目内容
【题目】为了减少 CO 对大气的污染,某研究性学习小组拟研究 CO 和 H2O 反应转化为绿色能源H2。已知:
2CO(g)+O2(g) =2CO2(g); H=-566kJ·moL-1
2H2(g)+O2(g) =2H2O(g); H=-483.6kJ·moL-1
H2O(g) =H2O(l); H=-44.0kJ·moL-1
(1)表示氢气燃烧热的化学方程式中 △H=__________。
(2)写出CO和 H2O(g)作用生成 CO2 和 H2 的热化学方程式____________________________________________。
(3)往 1L 体积不变的容器中加入 0.200mol CO 和 1.00mol H2O(g),在 t℃时反应并达到平衡,若该反应的化学平衡常数 K=1(方程式中各物质前化学计量数为最简比),则 t℃时 CO 的转化率为____;反应达到平衡后,升高温度,此时平衡常数将__________ (填“变大”、 “不变”或“变小”),平衡将向__________ (填“正”或“逆”)方向移动。
【答案】-285.8 CO(g)+H2O(g)=H2(g)+CO2(g) △H=-41.2KJmoL-1 50% 变小
【解析】
(1)通常条件下,1mol氢气完全燃烧生成液态水放出的热量为氢气的燃烧热,利用盖斯定律,根据已知热化学方程式乘以合适的系数进行相应加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减,据此书写判断;
(2)利用盖斯定律,根据已知热化学方程式乘以合适的系数进行相应加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减;
(3)令参加反应的CO的物质的量为nmol,利用三段式用n表示出平衡时各组分的物质的量,用物质的量代替浓度代入平衡常数计算n的值,再利用转化率定义计算;升高温度平衡向吸热反应移动,结合(2)中的热化学方程式判断,升高温度平衡移动方向,据此进行判断温度对平衡常数的影响。
(1) 已知:①2H2(g)+O2(g) =2H2O(g) △H=-483.6KJmoL-1;②H2O(g) =H2O(l) △H=-44.0KJ moL-1,根据盖斯定律,①×![]() +②得H2(g)+
+②得H2(g)+![]() O2(g) =H2O(l) △H=
O2(g) =H2O(l) △H=![]() ×(-483.6KJmoL-1)+(-44.0KJmoL-1)=-285.8KJmoL-1;故答案为:-285.8;
×(-483.6KJmoL-1)+(-44.0KJmoL-1)=-285.8KJmoL-1;故答案为:-285.8;
(2)已知:①2CO(g)+O2(g) =2CO2(g) △H=-566kJmoL-1;②2H2(g)+O2(g) =2H2O(g) △H=-483.6KJmoL-1,根据盖斯定律,①-②得2CO(g)+2H2O(g)=2H2(g)+2CO2(g) △H=-566kJmoL-1-(-483.6KJmoL-1)=-82.4KJmoL-1,即CO(g)+H2O(g)=H2(g)+CO2(g) △H=-41.2KJmoL-1,故答案为:CO(g)+H2O(g)=H2(g)+CO2(g) △H=-41.2KJmoL-1;
(3) 令参加反应的CO的物质的量为nmol,则:
CO(g)+H2O(g)=H2(g)+CO2(g)
开始(mol):0.200 1.00 0 0
变化(mol):n n n n
平衡(mol):0.200-n 1.00-n n n
所以![]() =1,解得n=
=1,解得n=![]() ,故t℃时CO的转化率为
,故t℃时CO的转化率为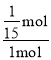 ×100%=6.67%;由(2)可知该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数变小,故答案为:50%;变小;逆;
×100%=6.67%;由(2)可知该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数变小,故答案为:50%;变小;逆;

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n (H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.20 | |
t2 | 0.80 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)=____________mol·L-1·min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=____________mol。
(3)温度升至800℃,上述反应平衡常数为0.64,则正反应为__________反应(填“放热”或“吸热”)。
(4)700℃时,向容积2L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应v(正)______v(逆)(填“>”、“<”或“=”)。
(5)若该容器体积不变,能判断反应达到平衡的是_______________。
①c(CO)与c(H2)的比值保持不变;②v(CO2)正=v(H2O)逆;③体系的压强不再发生变化;④混合气体的密度不变;⑤体系的温度不再发生变化;⑥气体的平均相对分子质量不变


