题目内容
工业上用电解饱和食盐水的方法生产氯气和烧碱.
(1)食盐溶于水发生电离,其电离方程式为______.
(2)2004年4月15日,某化工厂发生氯气泄漏事件,工作人员喷射NaOH溶液形成液幕,包围并吸收泄漏的氯气,其反应原理为______(用离子方程式表示).
(3)事件过后,附近居民向记者反映当时晾在外面的衣服褪色了,其原因是______(结合化学方程式解释).
解:(1)氯化钠是强电解质,在水分子作用下完全电离出阴阳离子,所以其电离方程式为:NaCl=Na++Cl-,故答案为:NaCl=Na++Cl-;
(2)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)氯气和水反应生成次氯酸,反应方程式为:Cl2+H2O=HCl+HClO,HClO具有强氧化性,可漂白,所以能使湿衣服褪色,
故答案为:Cl2+H2O=HCl+HClO,HClO具有强氧化性,可漂白.
分析:(1)氯化钠是强电解质,在水溶液里电离出阴阳离子;
(2)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(3)氯气和水反应生成次氯酸,次氯酸有漂白性.
点评:根据氯气的化学性质来分析解答,注意次氯酸有漂白性,但氯气没有漂白性.
(2)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)氯气和水反应生成次氯酸,反应方程式为:Cl2+H2O=HCl+HClO,HClO具有强氧化性,可漂白,所以能使湿衣服褪色,
故答案为:Cl2+H2O=HCl+HClO,HClO具有强氧化性,可漂白.
分析:(1)氯化钠是强电解质,在水溶液里电离出阴阳离子;
(2)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(3)氯气和水反应生成次氯酸,次氯酸有漂白性.
点评:根据氯气的化学性质来分析解答,注意次氯酸有漂白性,但氯气没有漂白性.

练习册系列答案
相关题目
浙江海洋经济发展示范区建设已上升为国家战略,海洋经济将成为浙江经济转型升级发展的重点.下列说法不正确的是( )
| A、从海水中提取溴单质的过程中涉及氧化还原反应 | B、从海带中提取碘单质的过程中涉及置换反应 | C、工业上用电解饱和食盐水的方法制取氯单质,产生氯气的一极连在电源的正极 | D、从海水中提取氯化钠的过程中涉及化学反应 |
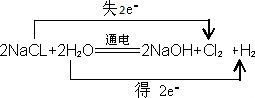
 (2010?枣庄一模)卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.
(2010?枣庄一模)卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.