题目内容
配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一提供空轨道的粒子结合。如NH就是由NH3(氮原子提供电子对)和H+(提供空轨道)通过配位键形成的。据此,回答下列问题:
(1)下列粒子中可能存在配位键的是
| A.CO2 | B.H3O+ | C.CH4 | D.[Ag(NH3)2] + |
(3)配位化学创始人维尔纳发现,将各为1mol的CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)、CoCl3·4NH3(紫色)四种配合物溶于水,加入足量硝酸银溶液,生成氯化银沉淀分别为3mol、2mol、1mol、和1mol。已知上述配合物中配离子的配位数均为6。请根据实验事实用配合物的形式写出它们的化学式。
①CoCl3·5NH3 ②CoCl3·4NH3(紫色)
(1)B D Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4 H2O
(3)①[Co(NH3)5Cl]Cl2 ②: [Co(NH3)4Cl2]Cl
解析试题分析:(1)A.CO2含有极性共价键;错误。B.H3O+含有极性共价键和配位键;正确。 C.CH4含有极性共价键;错误。D.[Ag(NH3)2] +含有极性共价键、配位键。正确。(2)向硫酸铜溶液中滴加氨水,首先发生沉淀反应:Cu2++2NH3·H2O= Cu(OH)2↓+2NH4+,产生蓝色Cu(OH)2沉淀。当氨水过量时发生络合反应:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-。沉淀逐渐溶解,变成含有四氨合铜离子的深蓝色溶液。(3)根据题意可知配合物中配离子的配位数均为6,络离子中的Cl-不能与Ag+结合。所以①CoCl3·5NH3的化学式为[Co(NH3)5Cl]Cl2;②CoCl3·4NH3的化学式为: [Co(NH3)4Cl2]Cl。
考点:考查离子方程式的书写及络合物、络离子的性质及化学式的书写的知识。

二氯化二硫(S2C12)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2C12是一种橙黄色液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2C12+2H2O=SO2↑+3S↓+4HCl。下列说法中错误的是
| A.S2C12的结构式为Cl—S—S—Cl |
| B.反应中SO2是还原产物,S是氧化产物 |
| C.S2C12为含有极性键和非极性键的分子 |
| D.反应中,生成1molSO2,转移电子为3mol |
过氧化氢(H2O2)俗称双氧水,外观为无色透明液体,是一种强氧化剂,适用于伤口及环境、食品消毒;实验室一般用过氧化钡(BaO2)与稀硫酸反应来制取。请问,过氧化钡(BaO2)中所含化学键为
| A.只有离子键 | B.离子键和共价键 |
| C.只有共价键 | D.离子键、共价键和氢键 |
CS2和S2Cl2都是硫的重要化合物,在工业上有广泛的用途。二者的部分性质如下:
| | 熔点/℃ | 沸点/℃ | 密度/g·cm—3[来源 | 水 |
| CS2 | —110.8 | 46.5 | 1.26 | 难溶 |
| S2Cl2 | —76 | 138 | 1.75 | 水解 |
(1)①在 CS2+3Cl2=CCl4(g)+S2Cl2反应中,化合价没发生变化的元素是 。
②在CS2和S2Cl2中,含有非极性键的是 。
(2)以CS2或单质硫做原料与氯气反应都可以制得S2Cl2。下图是实验室里通过在熔融的单质硫中通入少量氯气的方法制取S2Cl2的装置(夹持装置、加热装置均已略去)。
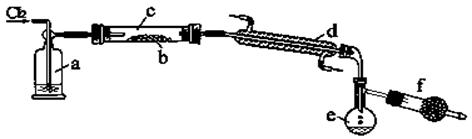
①装置a中的试剂是 ,其作用是 ;
装置d的名称是 ,其作用是 。
②该实验的操作顺序应是 (用序号表示)。
A.加热装置c B.通入Cl2 C.通冷凝水 D.停止通入Cl2
E.停止加热装置c
③f装置中的试剂是 ,其作用是 。
 键
键