题目内容
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)除去粗盐中杂质(Mg2+、SO![]() 、Ca2+ ),加入的药品顺序正确的是______ ( 填字母);
、Ca2+ ),加入的药品顺序正确的是______ ( 填字母);
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)制备钠单质的方法之一是将熔融NaCl进行电解,写出电解化学方程式:________________;
(3)步骤I中已获得Br2,步骤I中又将Br2还原为Br- ,其目的是_________________,写出步骤II中发生反应的化学方程式:_______________________;
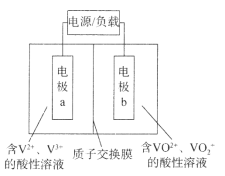
(4)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:

①图中仪器B的名称是_________________________________;
②C中收集到液体的颜色为__________________________________;
③Br2被过量Na2CO3溶液吸收的氧化产物为NaBrO3,则D中发生反应的化学方程式为_______________。
【答案】BC 2NaCl(熔融) ![]() 2Na+Cl2↑ 富集溴元素 Br2 +SO2+2H2O=2HBr+ H2SO4 直形冷凝管(或冷凝管) 深棕红色或红棕色 3Br2 +6Na2CO3 + 3H2O=NaBrO3+5NaBr + 6NaHCO3
2Na+Cl2↑ 富集溴元素 Br2 +SO2+2H2O=2HBr+ H2SO4 直形冷凝管(或冷凝管) 深棕红色或红棕色 3Br2 +6Na2CO3 + 3H2O=NaBrO3+5NaBr + 6NaHCO3
【解析】
海水淡化得到氯化钠,电解氯化钠溶液或熔融状态的氯化钠会生成氯气,氯气通入母液中发生反应得到低浓度的溴单质溶液,通入热空气吹出后用二氧化硫水溶液吸收得到含HBr和硫酸的溶液,再通入适量氯气氧化得到溴单质,富集溴元素,蒸馏得到工业溴,据此分析解答(1)~(3);
(4) 根据图示,从工业溴中提纯溴利用的原理是蒸馏,结合蒸馏的原理和碳酸钠的性质分析解答。
(1) 除去粗盐中杂质(Mg2+、SO![]() 、Ca2+),要先除SO
、Ca2+),要先除SO![]() 离子,然后再除Ca2+离子,碳酸钠可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,加NaOH除去Mg2+离子的顺序不受限制,将三种离子除完了,然后过滤,最后加盐酸除去过量的氢氧根离子和碳酸根离子即可,所以正确的操作顺序为:
离子,然后再除Ca2+离子,碳酸钠可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,加NaOH除去Mg2+离子的顺序不受限制,将三种离子除完了,然后过滤,最后加盐酸除去过量的氢氧根离子和碳酸根离子即可,所以正确的操作顺序为:
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸,最后加入的氯化钡溶液中过量的钡离子无法除去,故A错误;
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸,符合除杂原则,故B正确;
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸,符合除杂原则,故C正确;
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸,最后加入的氯化钡溶液中过量的钡离子无法除去,故D错误;故答案为:BC;
(2)制备钠单质的方法之一是将熔融NaCl进行电解,电解的化学方程式为:2NaCl(熔融)![]() 2Na+Cl2↑,故答案为:2NaCl(熔融)
2Na+Cl2↑,故答案为:2NaCl(熔融)![]() 2Na+Cl2↑;
2Na+Cl2↑;
(3) 因为低浓度的Br2溶液在提取时消耗过多的原料和能源,步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是富集溴元素,步骤Ⅱ中二氧化硫吸收溴单质发生的反应为:Br2+SO2+2H2O═H2SO4+2HBr,故答案为:富集溴元素;Br2+SO2+2H2O═H2SO4+2HBr;
(4)①根据图示,提纯溴利用的原理是蒸馏,仪器B为冷凝管,故答案为:冷凝管;
②控制温度59℃,使溴单质挥发,通过冷凝得到呈深红棕色的液态溴单质,故答案为:深棕红色;
③Br2与过量Na2CO3反应生成NaBrO3、NaBr和NaHCO3,D中发生反应的化学方程式为3Br2+6Na2CO3+3H2O=NaBrO3+5NaBr+6NaHCO3,故答案为:3Br2+6Na2CO3+3H2O=NaBrO3+5NaBr+6NaHCO3。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】Ⅰ、实验室里用乙醇和浓硫酸反应生成乙烯,乙烯再与溴反应制1,2 -二溴乙烷。在制备过程中部分乙醇被浓硫酸氧化,产生CO2、SO2,并进而与溴反应生成HBr等酸性气体。
(1)用下列仪器,以上述三种物质为原料制备1,2一二溴乙烷。如果气体流向为从左到右,正确的连接顺序是(短接口或橡皮管均已略去):B经A①插人A中,D接A②;A③接_______接_____接_____接______。
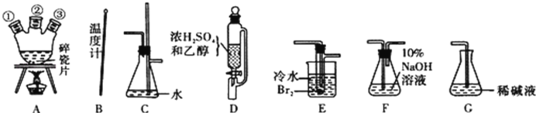
(2)装置C的作用是________________;
(3)在反应管E中进行的主要反应的化学方程式为____________________;
Ⅱ、某兴趣小组同学在实验室用加热l-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,设计了如下图所示的实验装置(其中的夹持仪器没有画出)。

请回答下列问题:
(1)两个装置中都用到了冷凝管,A装置中冷水从_________(填字母代号)进入,B装置中冷水从________(填字母代号)进入。
(2)制备操作中,加入的浓硫酸事先稍须进行稀释,其目的是________。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.水是反应的催化剂
(3)为了进一步提纯1-溴丁烷,该小组同学查得相关有机物的有关数据如下表:
物质 | 熔点/℃ | 沸点/℃ |
1-丁醇 | -89.5 | 117.3 |
1-溴丁烷 | -112.4 | 101.6 |
丁醚 | -95.3 | 142.4 |
1-丁烯 | -185.3 | -6.5 |
则用B装置完成此提纯实验时,实验中要迅速升高温度至_________收集所得馏分。
(4)有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)。请评价该同学设计的鉴定方案是否合理?________为什么?答:________。