题目内容
【题目】X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大。P元素的第三电子层处于全充满状态,第四电子层只有一个电子。请回答下列问题:
(1)基态X的外围电子电子排布图为_____,P元素属于_____ 区元素。
(2)XZ2分子的空间构型是_____,YZ2分子中Y的杂化轨道类型为_____,相同条件下两者在水中的溶解度较大的是_____(写分子式),理由是_____。
(3)含有元素N的盐的焰色反应为____色,许多金属盐都可以发生焰色反应,其原因是___。
(4)元素M与元素Q形成晶体中,M离子与Q离子的配位数之比为_____。
(5)P单质形成的晶体中,P原子采取的堆积方式为_____,P原子采取这种堆积方式的空间利用率为_____(用含π表达式表示)。
【答案】![]() ds V形 sp杂化 SO2 SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大 紫 电子由较高能级跃迁到较低能级时,以光的形式释放能量 2:1 面心立方最密堆积
ds V形 sp杂化 SO2 SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大 紫 电子由较高能级跃迁到较低能级时,以光的形式释放能量 2:1 面心立方最密堆积 ![]()
【解析】
X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素,X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,则Y为C元素;Z是地壳内含量最高的元素,为O元素;M的内层电子数是最外层电子数的9倍,M只能处于第四周期,最外层电子数只能为2,内层电子总数为18,核外电子总数为20,M为Ca元素;N的原子序数比M小1,则N为K元素;Q在元素周期表的各元素中电负性最大,Q为F元素;P元素的第三电子层处于全充满状态,第四电子层只有一个电子,原子核外电子数=2+8+18+1=29,则P为Cu元素,据此解答。
X为S元素,Y为C元素,Z为O元素,M为Ca元素,N为K元素,Q为F元素,P为Cu元素。
(1)X为S元素,元素在周期表中的位置是:第三周期ⅥA族,外围电子排布为3s23p4,它的外围电子的电子排布图为![]() ,P元素为Cu,属于ds区元素;
,P元素为Cu,属于ds区元素;
(2)SO2分子中S原子价层电子对数2+![]() =3,S原子含有1对孤电子对,所以其立体结构是V形,CO2分子C原子呈2个σ键、没有孤电子对,C的杂化轨道类型为sp杂化,SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大;
=3,S原子含有1对孤电子对,所以其立体结构是V形,CO2分子C原子呈2个σ键、没有孤电子对,C的杂化轨道类型为sp杂化,SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大;
(3)含有K元素的盐的焰色反应为紫色,许多金属盐都可以发生焰色反应,其原因是电子由较高能级跃迁到较低能级时,以光的形式释放能量;
(4)元素M与Q分别为Ca和F,形成的晶体为CaF2,Ca2+作面心立方最密堆积,F-做四面体填隙,Ca2+的配位数为8,F-的配位数为4,所以M离子与Q离子的配位数之比为2:1;
(5)P为Cu,P单质形成的晶体中,原子采取的堆积方式为面心立方最密堆积,一个晶胞中有Cu的个数为8×![]() 个,设Cu的半径为r,则V球=4×
个,设Cu的半径为r,则V球=4×![]() =
=![]() ,根据几何关系,晶胞边长为a=
,根据几何关系,晶胞边长为a=![]() 2
2![]() r,所以晶胞的体积V晶胞=a3=16
r,所以晶胞的体积V晶胞=a3=16![]() r3,所以空间利用率为
r3,所以空间利用率为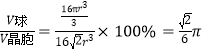 ×100%。
×100%。








