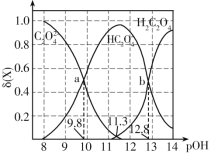
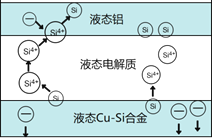
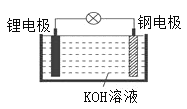
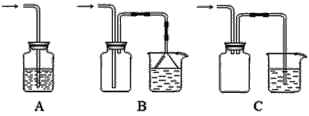
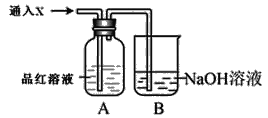
题目内容
【题目】某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉设计了如图装置进行实验:
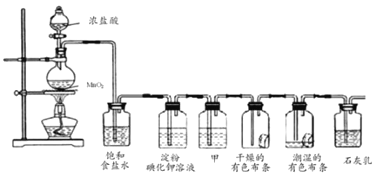
请按要求回答下列问题:
(1)圆底烧瓶中制氯气的化学方程式________;
(2)淀粉碘化钾溶液中观察到的现象是________;
(3)若干燥的有色布条不褪色潮湿的有色布条褪色,则甲中盛放________;
(4)![]() 与石灰乳反应制取漂白粉的化学方程式为________;
与石灰乳反应制取漂白粉的化学方程式为________;
(5)用下列两种方法制取氯气:①用含氯化氢146g的浓盐酸与足量的二氧化锰反应;②用87g二氧化锰与足量的浓盐酸反应,则所得氯气________。
A.②比①多 B.①比②多 C.一样多 D.无法比较
【答案】![]() 溶液变蓝 ;硫酸 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O A
溶液变蓝 ;硫酸 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O A
【解析】
(1)圆底烧瓶中用二氧化锰和浓盐酸加热制备氯气;
(2)氯气和碘化钾反应生成氯化钾和碘单质;
(3)干燥的有色布条不褪色,说明通入的氯气是干燥的氯气;
(4)![]() 与石灰乳反应生成氯化钙、次氯酸钙和水;
与石灰乳反应生成氯化钙、次氯酸钙和水;
(5)二氧化锰与稀盐酸不反应。
(1)圆底烧瓶中用二氧化锰和浓盐酸加热制备氯气,反应的化学方程式是![]() ;
;
(2)氯气和碘化钾反应生成氯化钾和碘单质,淀粉遇碘变蓝,所以淀粉碘化钾溶液中观察到的现象是溶液变蓝;
(3)干燥的有色布条不褪色,说明通入的氯气是干燥的氯气,所以甲中是干燥剂,则甲中盛放浓硫酸;
(4)![]() 与石灰乳反应生成氯化钙、次氯酸钙和水,反应方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
与石灰乳反应生成氯化钙、次氯酸钙和水,反应方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(5)①146g氯化氢的物质的量是4mol,二氧化锰与稀盐酸不反应,随反应进行,盐酸浓度降低,参加反应的氯化氢小于4mol,所以放出氯气的物质的量小于1mol;②87g二氧化锰的物质的量是1mol,根据反应方程式![]() ,1mol二氧化锰与足量的浓盐酸反应,生成氯气的物质的量是1mol,所以②比①多,故选A。
,1mol二氧化锰与足量的浓盐酸反应,生成氯气的物质的量是1mol,所以②比①多,故选A。

【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3- |
B | 向1 mL浓度均为0.05 mol·L-l NaCl、NaI的混合溶液中滴加2滴0.01 mol·L-l AgNO3溶液,振荡,沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
C | 室温下,用 pH 试纸分别测定浓度为 0.1mol/L NaClO溶液和0.1mol/L CH3COONa溶液的pH | 比较HC1O和CH3COOH的酸性强弱 |
D | 浓硫酸与乙醇180℃共热,制得的气体通入酸性KMnO4 溶液,溶液紫色褪去 | 制得的气体为乙烯 |
A.AB.BC.CD.D
【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:

已知如下信息:
①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
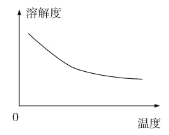
②碳酸锂的溶解度与温度关系如图所示:
③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为________。滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和__________(填化学式)。
(2)调节pH=5的目的是__________。
(3)“沉锂”包括过滤、洗涤等,宜用_________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 |
| 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 10.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______(填序号)方案投料。
(4)“除杂2”中调pH=13时c(Mg2+)=_________mol·L-1。
(5)“合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式________。
(6)在“合成”中制备1 mol LiCoO2转移电子的物质的量为__________。