题目内容
【题目】2019年10月9日,瑞典皇家科学院在斯德哥尔摩宣布,将2019年诺贝尔化学奖颁发给来自美国、英国、日本的三位科学家,表彰他们在锂离子电池方面的研究贡献。钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
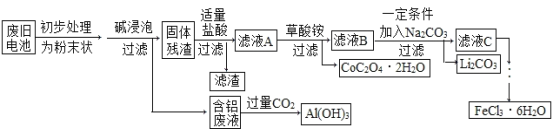
已知:①还原性:Cl->Co2+;
②Fe3+和C2O42-结合生成较稳定的[ Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。
回答下列问题:
(1)废旧电池初步处理为粉末状的目的是_______________。
(2)从含铝废液得到Al(OH)3的离子反应方程式为_______。
(3)写出LiCoO2和盐酸反应的化学方程式________________。滤液A中的溶质除HCl、LiCl外还有__________(填化学式)。
(4)滤渣的主要成分为____________________(填化学式)。
(5)从FeCl3溶液中得到FeCl3·6H2O固体的操作:先_________,再蒸发浓缩、冷却结晶。
(6)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2
②固体失重率=对应温度下样品失重的质量/样品的初始质量
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120-220 | CoC2O4·2H2O | 19.67% |
Ⅱ | 300~350 | _________________________ | 59.02% |
【答案】增大接触面积,加快反应速率,提高浸出率 AlO2-+CO2+2H2O==Al(OH)3↓+HCO3- 2LiCoO2+8HCl==2CoCl2+Cl2↑+4H2O+2LiCl FeCl3、CoCl2 C 加入适量盐酸(或通入适量氯化氢气体) ![]()
【解析】
(1)废旧电池初步处理为粉末状的目的是增大接触面,加快反应速率,提高浸出率,
答案为:增大接触面积,加快反应速率,提高浸出率;
(2)铝废液含有![]() ,通入过量的
,通入过量的![]() 得到碳酸氢根离子和氢氧化铝沉淀,离子反应方程式为:
得到碳酸氢根离子和氢氧化铝沉淀,离子反应方程式为:![]() ,
,
故答案为![]() ;
;
(3)因还原性![]() ,且滤液A中含有的是
,且滤液A中含有的是![]() ,所以
,所以![]() 和盐酸发生氧化还原反应生成氯气和
和盐酸发生氧化还原反应生成氯气和![]() ,方程式为:
,方程式为:![]() ,碱浸后的固体残渣不含铝,钴酸锂中的三价
,碱浸后的固体残渣不含铝,钴酸锂中的三价![]() 有强氧化性,把铁氧化为三价铁离子,本身被还原为
有强氧化性,把铁氧化为三价铁离子,本身被还原为![]() ,碳单质一般性质稳定,不与酸碱盐反应成为滤渣,故滤液A中还含有
,碳单质一般性质稳定,不与酸碱盐反应成为滤渣,故滤液A中还含有![]() 和
和![]() ,
,
故答案为:![]() ;
;![]() 、
、![]()
(4)碳单质一般性质稳定,不与酸碱盐反应成为滤渣,故滤渣的主要成分是![]() ,
,
故答案为:![]() ;
;
(5)氯化铁易水解得到氢氧化铁沉淀,所以要先加盐酸或通入氯化氢气体,抑制氯化铁的水解,
故答案为:加入适量盐酸(或通入适量氯化氢气体);
(6)由①可知,在120~220℃时,![]() 完全失去结晶水生成
完全失去结晶水生成![]() ,然后继续升高温度加热,则
,然后继续升高温度加热,则![]() 分解生成氧化物,其分解失去的质量为183g×59.02%=108g,剩余的质量为183g-108g=75g,设产物的化学式为
分解生成氧化物,其分解失去的质量为183g×59.02%=108g,剩余的质量为183g-108g=75g,设产物的化学式为![]() ,则
,则![]() ,解得
,解得![]() ,则化学式为
,则化学式为![]() ,故方程式为:
,故方程式为:![]() ,
,
故答案为:![]() 。
。