题目内容
在1 L含0.1 mol NaAlO2和0.1 mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.1 mol/L的H2SO4溶液,下列图象 中能表示反应产生沉淀的物质的量与加入硫酸溶液体积之间关系的是
中能表示反应产生沉淀的物质的量与加入硫酸溶液体积之间关系的是
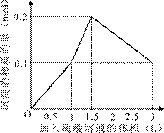
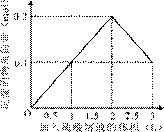
A B
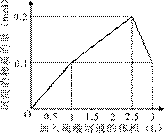
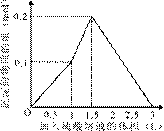
C D
 中能表示反应产生沉淀的物质的量与加入硫酸溶液体积之间关系的是
中能表示反应产生沉淀的物质的量与加入硫酸溶液体积之间关系的是

A B


C D
A
略

练习册系列答案
相关题目
 H∶OH
H∶OH