题目内容
【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]___,下列状态的铝中,电离最外层的一个电子所需能量最小的是___(填标号)。
A.![]() B.
B.![]() C.[Ne] D.
C.[Ne] D.![]()
(2)8一羟基喹啉铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与(8一羟基喹啉 )合成。LiAlH4中阴离子的空间构型为____;所含元素中电负性最大的是___(填元素符号),C、N、O的杂化方式依次为____、_____和____。
)合成。LiAlH4中阴离子的空间构型为____;所含元素中电负性最大的是___(填元素符号),C、N、O的杂化方式依次为____、_____和____。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/°C | 1040 | 1000 | 194 |
①表中卤化物的熔点产生差异的原因是_____。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6,二聚体Al2Cl6的结构式为____;其中Al的配位数为____。
(4)GaAs的晶胞结构如图所示,其晶胞参数为apm。

①紧邻的As原子之间的距离为x,紧邻的As、Ga原子之间的距离为y,则![]() __。
__。
②设阿伏加德罗常数的值为NA,则GaAs的密度是___g·cm一3(列出计算表达式)。
【答案】3d104s24p3 D 正四面体 O sp2 sp2 sp3 AlF3、GaF3为离子晶体,AlCl3为分子晶体,晶格能:AlF3>GaF3 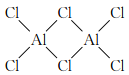 4
4 ![]()
![]()
【解析】
(1)As为33号元素,位于第四周期,依据核外电子排布规律写出基态As原子核外电子排布式;依据铝的第三电离能大于第二电离能,大于第一电离能;基态大于激发态,故D所需的能量最低。
(2)LiAlH4中阴离子为AlH4- ,n=(3+4+1)/2=4,Al无孤对电子,判断离子构型;8一羟基喹啉中环上的C、N、O的价层电子对去判断。
(3)依据物质组成及熔点等性质确定晶体类型。离子晶体熔点一般比分子晶体的高,离子晶体熔点由晶格能相对大小决定。
(4)根据晶胞的立体结构①紧邻的两个As原子的距离为![]() ,上述晶胞拆成8个等大的小立方体,4个的体心位置由Ga原子填充。小立方体的棱长为0.5a pm,则其体对角线长为
,上述晶胞拆成8个等大的小立方体,4个的体心位置由Ga原子填充。小立方体的棱长为0.5a pm,则其体对角线长为![]() ,则紧邻的As、Ga原子之间的距离
,则紧邻的As、Ga原子之间的距离![]() ,进而求出x/y。
,进而求出x/y。
②先求出:晶胞中含4个Ga、4个As,总质量为![]() ,再求出体积为(a×10-10)3cm3,由密度=m/V计算。
,再求出体积为(a×10-10)3cm3,由密度=m/V计算。
(1)As为33号元素,基态原子核外电子排布式为[Ar]3d104s24p3;依据铝的第三电离能大于第二电离能,大于第一电离能;基态大于激发态,故D所需的能量最低。
(2)LiAlH4中阴离子为AlH4-,n=(3+4+1)/2=4,Al无孤对电子,故为正四面体;8一羟基喹啉中环上的C、N均为sp2杂化,羟基氧为sp3杂化。
(3)依据物质组成及熔点可确定AlF3、GaF3为离子晶体,AlCl3为分子晶体。离子晶体熔点一般比分子晶体的高,离子晶体熔点由晶格能相对大小决定。
(4)①紧邻的两个As原子的距离为![]() ,上述晶胞拆成8个等大的小立方体,4个的体心位置由Ga原子填充。小立方体的棱长为0.5a pm,则其体对角线长为
,上述晶胞拆成8个等大的小立方体,4个的体心位置由Ga原子填充。小立方体的棱长为0.5a pm,则其体对角线长为![]() ,则紧邻的As、Ga原子之间的距离
,则紧邻的As、Ga原子之间的距离![]() ,
,![]() 。
。
②晶胞中含4个Ga、4个As,总质量为![]() ,体积为(a×10-10)3cm3,则密度为
,体积为(a×10-10)3cm3,则密度为![]() 。
。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)⑧的原子结构示意图为_________;
(2)②的气态氢化物分子的结构式为___________,②和⑦的气态氢化物的稳定性相比,其中较弱的是____ (用该氢化物的化学式表示);
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是____(填化学式);
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”);
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”);
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:_____。
【题目】高炉炼铁过程中发生的反应:1/3Fe2O3(s)+CO(g)2/3Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表,下列说法正确的是
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
A. △H>0
B. 该反应的平衡常数表达式是![]()
C. 其他条件不变,向平衡体系充入CO2气体,K值减小
D. 其他条件不变,增大压强,平衡往逆向移动
【题目】M、N、X、Y四种主族元素在周期表里的相对位置如下图所示,已知它们的原子序数总和为46。
M | N | ||
X | Y |
(1)M与Y形成的化合物中含________键,属__________分子。(填“极性”或“非极性”)
(2)N元素形成的单质分子中的化学键类型及数目是__________________(填“σ键”或“π键”)。在化学反应中________易断裂。
(3)由N、Y的氢化物相互作用所生成的物质的电子式为____________________________。其中的化学键有__________________________。
(4)写出M单质与X元素最高价氧化物对应的水化物反应的化学方程式_______________________________________________________________________。
(5)核电荷数比X元素少8的元素可形成多种粒子,按要求填入空格中:
质子数 | 16 | 16 | 16 |
电子数 | 16 | 17 | 17 |
化学式 | ___________ | ________ | _________ |



