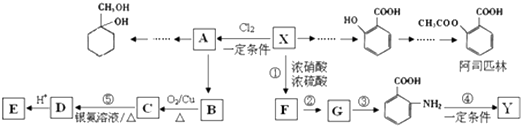
题目内容
【题目】A、B、C、D、E五种物分别是NaOH、NH3H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
①0.001mol/L的A溶液pH=3;
②B溶液和D溶液显碱性,等浓度两者PH关系B<D;
③E是弱电解质.回答下列问题:
(1)D是溶液,判断理由是 .
(2)用水稀释0.1molL﹣1 B时,溶液中随着水量的增加而减小的是(填写序号).
① ![]() ②
② ![]() ③c(H+)和c(OH﹣)的乘积 ④OH﹣的物质的量
③c(H+)和c(OH﹣)的乘积 ④OH﹣的物质的量
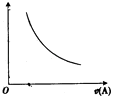
(3)将等体积、等物质的量浓度B和C的溶液混合,升高温度(溶质不会分解)溶液pH随温度变化为图中的曲线(填写序号).
(4)OH﹣浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是(填写序号).
①反应所需要的时间E>A
②开始反应时的速率A>E
③参加反应的锌的物质的量A=E
④反应过程的平均速率E>A
⑤A溶液里有锌剩余
⑥E溶液里有锌剩余.
【答案】
(1)NaOH;中和酸性物质A只有NaOH、NH3?H2O,等物质的量的A与等物质的量浓度B和D混合呈中性,D用的体积少,说明D碱性比B的碱性强,所以D是NaOH
(2)①
(3)④
(4)③④⑤
【解析】解:①0.001mol/L的A溶液pH=3,所以A是一元强酸,是盐酸;②NaOH和NH3H2O溶液显碱性,等浓度两者PH关系B<D,所以D是氢氧化钠,B是氨水;③E是弱电解质,则是CH3COOH,所以C为NH4HSO4 , (1)D是氢氧化钠溶液,判断理由是中和酸性物质A只有NaOH、NH3H2O,等物质的量的A与等物质的量浓度B和D混合呈中性,D用的体积少,说明D碱性比B的碱性强,所以D是NaOH,所以答案是:NaOH;中和酸性物质A只有NaOH、NH3H2O,等物质的量的A与等物质的量浓度B和D混合呈中性,D用的体积少,说明D碱性比B的碱性强,所以D是NaOH;(2)①用水稀释氨水,电离平衡向电离方向移动,n(NH3H2O)减小,n(OH﹣)增大,溶液体积不变,浓度之比等于物质的量之比, ![]() 减小,故正确;②用水稀释氨水,电离平衡向电离方向移动,n(NH3H2O)减小,n(OH﹣)增大,所以氢离子的浓度减少,则
减小,故正确;②用水稀释氨水,电离平衡向电离方向移动,n(NH3H2O)减小,n(OH﹣)增大,所以氢离子的浓度减少,则 ![]() 增大,故错误;③温度不变,c(H+)和c(OH﹣)的乘积不变,故错误; ④OH﹣的物质的量增大,故错误;所以答案是:①;(3)等体积、等物质的量浓度B和C混合后得到(NH4)2SO4溶液,NH4+水解溶液显酸性,PH<7,①②错误;加热水解平衡向右移动,c(H+)增大,酸性增强,PH减小,③错误、④正确,所以答案是:④;(4)①根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+ , 反应速率比盐酸中快,产生的氢气一样多,反应所需要的时间HCl>CH3COOH,故①错误;②根据酸能与锌反应得到氢气,开始溶液中c(H+)相等,反应时的速率HCl=CH3COOH,故②错误;③根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故③正确;④根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+ , 反应速率比盐酸中快,故④正确;⑤根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑤正确;⑥根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑥错误;所以答案是:③④⑤.
增大,故错误;③温度不变,c(H+)和c(OH﹣)的乘积不变,故错误; ④OH﹣的物质的量增大,故错误;所以答案是:①;(3)等体积、等物质的量浓度B和C混合后得到(NH4)2SO4溶液,NH4+水解溶液显酸性,PH<7,①②错误;加热水解平衡向右移动,c(H+)增大,酸性增强,PH减小,③错误、④正确,所以答案是:④;(4)①根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+ , 反应速率比盐酸中快,产生的氢气一样多,反应所需要的时间HCl>CH3COOH,故①错误;②根据酸能与锌反应得到氢气,开始溶液中c(H+)相等,反应时的速率HCl=CH3COOH,故②错误;③根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故③正确;④根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+ , 反应速率比盐酸中快,故④正确;⑤根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑤正确;⑥根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑥错误;所以答案是:③④⑤.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

 应用题作业本系列答案
应用题作业本系列答案【题目】已知CaSO4受热分解,由于受热温度不同,气体成分也不同.气体成分可能为SO2、SO3和O2中的一种、二种或三种.某化学课外活动小组准备通过系列实验探究CaSO4分解生成的气体,进而确定CaSO4分解的化学方程式.
(1)[提出猜想]Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有二种;(填分子式)
(2)Ⅲ.所得气体的成分可能含有 SO2、SO3、O2三种.[设计实验]
该化学课外活动小组准备通过测定D装置的增重以及量筒中水的体积,来探究CaSO4分解生成的气体成分,进而确定CaSO4分解的化学方程式.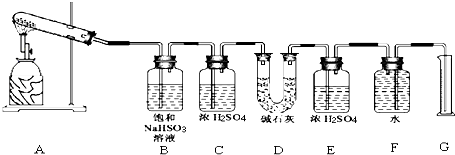
[实验过程]
根据上述实验方案进行试验.已知实验结束时,CaSO4完全分解.
请结合以下实验现象和记录的实验数据进行分析:
①若实验结束时,G中量筒没有收集到水,则证明猜想正确.(填Ⅰ或Ⅱ或Ⅲ)
②若实验结束时,装置D的总质量增加,能否断定气体产物中一定含有SO2而不含SO3?请说明理由: .
③该实验设计中,容易给测定带来较大误差的因素有 .
(写出一种即可)
④经改进后,有两组同学进行该实验,由于加热时的温度不同,实验测得数据也不同,
相关数据如下:
实验小组 | 称取CaSO4 | 装置D增加 | 量取气体体积的装置测量的气体体积 (折算成标准状况下气体的体积) (mL) |
一 | 4.08 | 2.56 | 224 |
二 | 5.44 | 2.56 | 448 |
请通过计算,推断第二组同学得出的CaSO4分解的化学反应方程式:
第二组: .