题目内容
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。回答下列问题:
(1)基态P原子的核外电子排布式为____________________,有___________个未成对电子。
(2)磷的一种同素异形体一一白磷(P4)的立体构型为_______________,其键角为___________,推测其在CS2中的溶解度___________(填“大于”或“小于”)在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因_________________________________。
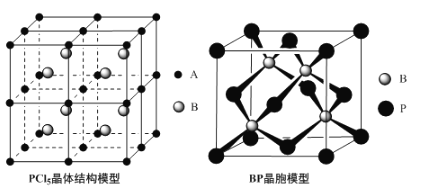
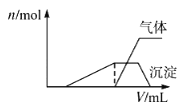
(4)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如上左图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A为___________,其中心原子杂化轨道类型为___________,B为___________。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,上图为其立方晶胞,其中的每个原子均测是8电子稳定结构,试判断其熔点___________(填“高于”或“低于”)金刚石熔点。已知其B—P键长均为xcm,则其密度为___________g·cm-3(列出计算式即可)。
【答案】1s22s22p63s23p3 3 正四面体 60° 大于 电负性N强于P,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间距离越小,成键电子对之间的斥力增大,键角变大 PCl4+ sp3 PCl6- 低于 ![]() 或
或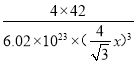
【解析】
(1)根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写;
(2)白磷分子是正四面体结构,四个P原子位于正四面体顶点上,物质溶解性遵循相似相溶原理;
(3)NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化,孤对电子对成键电子的排斥作用较强,氨气分子空间构型是三角锥形,电负性N强于P,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间距离越小;
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PCl6-,即发生反应为:2PCl5=PCl4++PCl6-;
(5)晶胞中:P位于顶点和面心,数目为8×![]() +6×
+6×![]() =4,B位于晶胞内,数目为4,则磷化硼晶体的化学式为BP,由于磷化硼是一种超硬耐磨涂层材料,属于原子晶体,B-P键和C-C键相比,键长大,则熔点低于金刚石;再根据ρ=
=4,B位于晶胞内,数目为4,则磷化硼晶体的化学式为BP,由于磷化硼是一种超硬耐磨涂层材料,属于原子晶体,B-P键和C-C键相比,键长大,则熔点低于金刚石;再根据ρ=![]() 计算密度。
计算密度。
(1)P元素为15号元素,原子核外有15个电子,所以核外电子排布式为:1s22s22p63s23p3,p轨道上是三个自旋方向相同的三个未成对电子;
故答案为:1s22s22p63s23p3;3;
(2)白磷分子是正四面体结构,四个P原子位于正四面体顶点上,所以键角是60°,为非极性分子,相似相容原理可知,易溶于非极性溶剂中,二硫化碳为非极性溶剂,所以白磷在CS2中的溶解度大于在水中的溶解度;
故答案为:正四面体形;60°;大于;
(3)NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,孤对电子对成键电子的排斥作用较强,N-H之间的键角小于109°28′,所以氨气分子空间构型是三角锥形,电负性N强于P,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间距离越小,成键电子对之间的排斥力增大,键角变大,PH3的键角小于NH3的键角;
故答案为:电负性N强于P,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间距离越小,成键电子对之间的排斥力增大,键角变大;
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PCl6-,即发生反应为:2PCl5=PCl4++PCl6-,已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A为:PCl4+,PCl4+中P没有孤电子对。含四个σ键,所以原子杂化方式是sp3,B为:PCl6-;
故答案为:PCl4+;sp3;PCl6-;
(5)磷化硼(BP)与金刚石对比,B、P的原子半径大于C,则磷化硼(BP)中的键长大于金刚石,键能小于金刚石,故其熔点低于金刚石的熔点;根据磷化硼晶胞模型可知,1个晶胞中含有4个硼原子,P=8×![]() +6×
+6×![]() =4,则1mol晶胞中含有4molBP,晶胞的棱长=2
=4,则1mol晶胞中含有4molBP,晶胞的棱长=2![]() xsin54°44’,则体积为=(2
xsin54°44’,则体积为=(2![]() xsin54°44’)3,ρ=
xsin54°44’)3,ρ=![]() =
=![]() 或
或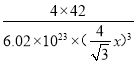 ;
;
故答案是:低于;![]() 或
或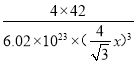 。
。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案