题目内容
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(填元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式__________。
(5)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为__________。Q与水反应的化学方程式为__________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种气体组成,气体的相对分子质量都小于50.为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol/LNaOH溶液和1molO2,则两种气体的分子式及物质的量分别为__________。
【答案】第三周期,ⅦA族SiacSi(s)+2Cl2(g)=SiCl4(l) △H=687 kJ/mol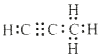 Mg2C3+4H2O=2 Mg(OH)2+C3H4↑NO 0.9 mol;NO2 1.3 mol
Mg2C3+4H2O=2 Mg(OH)2+C3H4↑NO 0.9 mol;NO2 1.3 mol
【解析】
根据元素周期表结构可知,X为Si元素,Y为O元素,Z为Cl元素;
(1)Z为Cl元素,其原子序数为17,原子结构示意图为: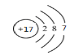 ,位于周期表中第三周期、ⅦA族;正确答案:第三周期,ⅦA族。
,位于周期表中第三周期、ⅦA族;正确答案:第三周期,ⅦA族。
(2)同一周期从左向右,原子半径逐渐减小,同一主族从上到下,原子半径逐渐增大,则原子半径最大的为Si;正确答案:Si。
(3)a、Y为O元素,氧气与H2S溶液反应,溶液变浑浊,说明氧气的氧化性比硫强,则说明氧元素的非金属性比S元素的非金属性强,故a正确;
b、Y为O元素,在氧化还原反应中,1mol氧气比1molS得电子多,氧化性强弱与得失电子数没有必然关系,故b错误;
c、元素的非金属性越强,氢化物的稳定性越强,O和S两元素的简单氢化物受热分解,前者的分解温度高,说明O的非金属性较强,故c正确;
所以能说明非金属性O大于S的有a、c,正确选项ac。
(4)X的单质为Si,室温下为固态,Z的单质为Cl2,室温下为气态,反应生成X的最高价化合物为SiCl4,熔、沸点分别为-69℃和58℃, 则SiCl4室温下为液态,热化学方程式为Si(s)+2Cl2(g)=SiCl4(l) △H=687 kJ/mol;正确答案:Si(s)+2Cl2(g)=SiCl4(l) △H=687 kJ/mol。
(5)烃分子中碳氢原子质量比为9:1,设烃为CxHy,则碳氢原子个数比为12×x/y=9/1,x:y=3:4;则该烃分子式为C3H4,为丙炔,电子式为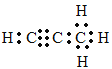 ;1molQ与水反应生成2molMg(OH)2,根据镁元素守恒,可知化合物Q为Mg2Ca,根据碳原子守恒,可知a=3,所以Q为Mg2C3,它与水反应的化学方程式为:Mg2C3+4H2O=2Mg(OH)2+C3H4↑;正确答案:
;1molQ与水反应生成2molMg(OH)2,根据镁元素守恒,可知化合物Q为Mg2Ca,根据碳原子守恒,可知a=3,所以Q为Mg2C3,它与水反应的化学方程式为:Mg2C3+4H2O=2Mg(OH)2+C3H4↑;正确答案: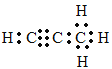 ;Mg2C3+4H2O=2Mg(OH)2+C3H4↑。
;Mg2C3+4H2O=2Mg(OH)2+C3H4↑。
(6)铜与硝酸和硫酸的混合酸反应生成气体的相对分子质量小于50,且生成的盐只有硫酸铜,因此该气体为NO、NO2。设NO、NO2的物质的量分别为x、y,NO、NO2与NaOH溶液和氧气反应,最终生成NaNO3,根据氮元素守恒可知:x+y=n(NO3-),根据物料守恒有n(NO3-)=n(Na+)=n(NaOH)=1×2.2=2.2mol,根据得失电子守恒,有3x+y= 4n(O2)=4mol,计算可得x=0.9mol,y=1.3mol;正确答案: NO、 0.9 mol;NO2 、1.3 mol。

【题目】向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2) ![]() 0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
A. A B. B C. C D. D
【题目】(1)甲醇是一种可再生能源,用途广泛,一种由甲醇、氧气以及强碱溶液制成的新型手机电池,容量达氢镍电池或锂电池的10倍。回答下列有关问题:
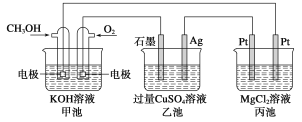
如图所示:
①甲池通入CH3OH的电极反应式为__________;乙池石墨一极的电极反应式为______;
②反应一段时间后,向乙池中加入一定量________能使CuSO4溶液恢复到原浓度;
③甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生__________g沉淀。
(2)工业上有一种生产甲醇的反应:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1。在某温度下,容积均为2L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1。在某温度下,容积均为2L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
容器 | A | B |
反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
CH3OH(g)浓度(molL-1) | c1 | c2 |
反应能量变化 | 放出29.4kJ | 吸收akJ |
①从反应开始至达到平衡时,A中用CO2来表示的平均反应速率为______________;
②该温度下,反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的化学平衡常数的值为_____________;
CH3OH(g)+H2O(g)的化学平衡常数的值为_____________;
③a=______________。
④下列措施中能使n(CH3OH)/n(CO2)增大的是____________。
A.升高温度 B.充入氢气
C.将水蒸气从体系中分离 D.用更有效的催化剂
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
