题目内容
20.金刚石和石墨是碳元素的两种结构不同的单质.在101kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的能量.下列说法不正确的是( )| A. | 石墨比金刚石稳定 | |
| B. | 1mol石墨和金刚石完全燃烧时释放的能量石墨比金刚石少 | |
| C. | 金刚石与石墨的性质相似 | |
| D. | 1mol金刚石比1mol石墨的总能量高 |
分析 在101kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的能量说明石墨的能量低于金刚石的能量,石墨更稳定.金刚石的能量高,1mol石墨和金刚石完全燃烧时释放的能量金刚石比石墨多.
解答 解:A、石墨转化为金刚石要吸收能量,说明石墨的能量低,稳定,故A正确;
B、金刚石的能量高,1mol石墨和金刚石完全燃烧时释放的能量金刚石比石墨多,故B正确;
C、金刚石和石墨都是由碳元素组成的单质,化学性质相似,由于碳原子排列方式不同,物理性质相差很大,故C错误;
D、在101kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的能量说明石墨的能量低于金刚石的能量,故D正确,
故选C.
点评 本题考查金刚石和石墨的转化以及涉及到的能量变化,题目难度不大,明确物质自身具有能量越低越稳定.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.苯乙烯是一种重要的有机化工原料,其结构简式为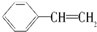 ,它一般不可能具有的性质是( )
,它一般不可能具有的性质是( )
 ,它一般不可能具有的性质是( )
,它一般不可能具有的性质是( )| A. | 易溶于水,不易溶于有机溶剂 | |
| B. | 在空气中燃烧产生浓烟 | |
| C. | 所有的原子可能共平面 | |
| D. | 能与浓硝酸在浓H2SO4作用下发生取代反应 |
11.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB═NH)3通过如下反应制得:3CH4+2(HB═NH)3+6H2O═3CO2+6H3BNH3.对合成A反应方程式的讨论中不正确的是( )
| A. | 反应前后碳原子的杂化类型不变 | B. | 键角的大小关系:CO2>CH4>H2O | ||
| C. | 第一电离能大小关系:N>O>C>B | D. | 生成物H3BNH3中存在配位键 |
8.下列实验操作中错误的是( )
| A. | 称量NaOH时,NaOH置于滤纸上放在托盘天平左盘,砝码放在右盘 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 配制稀硫酸时,先在烧杯中加入一定量水,再沿玻璃棒慢慢加入浓硫酸 |
15.下列水溶液中能大量共存的一组离子是( )
| A. | K+、Al3+、CO32-、Cl- | B. | K+、Fe3+、HCO3-、S2- | ||
| C. | H+、Mg2+、SO42-、Cl- | D. | H+、Fe2+、Cl-、NO3- |
12.下列说法不正确的是( )
| A. | 据报道,《自然》在2013年2月介绍了由浙江大学用石墨烯制造出的目前世界上最轻固体材料“碳海绵”,碳海绵与金刚石的关系可能是同素异形体 | |
| B. | 2013年浙江省多地遭遇雾霾天气,有报道称雾霾颗粒中汽车尾气占20%以上,已知汽车尾气中的主要污染物为NOX、CO、燃烧源超细颗粒(PM2.5)等有害物质,其中PM2.5(PM单位为百万分之一米)颗粒大小约等于胶体粒子 | |
| C. | 石头纸就是用磨成粉末的石灰石为主要原料,加上15%高分子有机材料聚乙烯和5%胶合剂做成.可以应用在笔记本,纸袋,餐盒等许多用途上,这种纸防水不易燃烧,最重要的是不用砍树造纸,非常环保,还能为国家节约大量的石油资源 | |
| D. | 与传统的石油系油墨相比,大豆油墨有相当多的优点:主要含食用色拉油,可再生,无危害,耐擦.通常报纸用纸80%以上采用再生纸,利用大豆油墨比普通油墨更容易脱墨的特性,废纸回收再生时废料少,回收成本低,新闻报纸行业可选择用乙醇等有机溶剂进行脱墨 |
9.一定温度下,向容积恒定的密闭容器中投入1mol A和1mol B,发生如下可逆反应:2A(g)+B(g)═C(g)+D(s),达到平衡时,测得压强为原压强的四分之三.则B的转化率为( )
| A. | 25% | B. | 40% | C. | 50% | D. | 75% |
2. (1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)?CO2(g)+H2(g);△H<0 CO和H2O浓度变化如图,则0~4min的平均反应速率v(H2O)=0.03mol/(L•min);
(2)该反应的化学平衡常数表达式K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$.
T℃时物质浓度(mol/L)的变化
(3)T℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表.表中3min~4min 时间段之间反应处于平衡状态.
 (1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0 CO和H2O浓度变化如图,则0~4min的平均反应速率v(H2O)=0.03mol/(L•min);
(2)该反应的化学平衡常数表达式K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$.
T℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
 ;
;  ;
; ;
;  .
.