题目内容
【题目】有反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,
2NH3(g) ΔH<0,
(1)在恒温恒压条件下进行,反应正向进行的是________;反应逆向进行的是________;处于平衡状态的是________;无法判断是否达到平衡的是________。
A.单位时间内生成1mol N2,同时生成3mol NH3
B.单位时间内生成3mol N2,同时生成6mol N—H键
C.混合气体的密度不再随时间而改变
D.容器中气体的压强不再随时间而改变
(2)在一定温度下某恒容密闭容器中,充入3molH2和1mol的N2,2min达到平衡状态时,总的气体的物质的量变为原来的9/10,则此时N2的转化率为__________;
若此时放出的热量为18.44 kJ,则其热化学方程式为______________________________ .
根据所求出的热化学方程式,且已知1mol氮氮三键断裂需要为945.8kJ的能量,1mol氢氢键断裂需要436 kJ的能量,求1molN-H键断裂吸收的能量_____。
(3)氨气可用作碱性燃料电池的燃料,电池反应为4NH3+3O2═2N2+6H2O,
则氨燃料电池的负极电极反应为________________________________________________.
【答案】 A B D C 20% N2(g)+3H2(g) ![]() 2NH3(g) ΔH= -92.2 kJ/mol 391 kJ 4NH3 +12OH- -12e- =2N2+12H2O
2NH3(g) ΔH= -92.2 kJ/mol 391 kJ 4NH3 +12OH- -12e- =2N2+12H2O
【解析】(1)A.单位时间内生成1mol N2,同时生成3mol NH3,生成的NH3多于2mol,故反应正向进行;B.单位时间内生成3mol N2,是逆速率,相当于同时生成18molN—H键,所以同时生成6mol N—H键,逆速率大,故反应逆向进行;C、混合气体的密度不再随时间而改变,由于反应前后全是气体,故不能判断是否达到平衡;D.反应前后气体发生变化,容器中气体的压强不再随时间而改变,说明反应达到平衡。故答案为:A、B、D、C。
(2)在一定温度下某恒容密闭容器中,充入3molH2和1mol的N2,2min达到平衡状态时,总的气体的物质的量变为原来的9/10,则此时N2的转化率为
N2 +3H2![]() 2NH3
2NH3
起始(mol) 1 3 0
转化(mol) x 3x 2x
平衡(mol) 1-x 3-3x 2x
(1-x)+(3-3x)+2x=(1+3)×9/10,x=0.2,此时N2的转化率为0.2mol/1mol=0.2;
若此时放出的热量为18.44 kJ,1molN2完全反应,放出的热量为18.44 kJ/0.2=92.2 kJ,
则其热化学方程式为 N2(g)+3H2(g) ![]() 2NH3(g) ΔH= -92.2 kJ/mol
2NH3(g) ΔH= -92.2 kJ/mol
在反应N2+3H2![]() 2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+945.8kJ=2253.8kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×xkJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:6xkJ-2253.8kJ=92.2kJ,x=391;1molN-H键断裂吸收的能量391 kJ
2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+945.8kJ=2253.8kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×xkJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:6xkJ-2253.8kJ=92.2kJ,x=391;1molN-H键断裂吸收的能量391 kJ
(3)氨气可用作碱性燃料电池的燃料,电池反应为4NH3+3O2═2N2+6H2O,NH3为还原剂,则氨燃料电池的负极电极反应为4NH3 +12OH- -12e- =2N2+12H2O

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】过氧乙酸(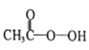 )是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如下:
)是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如下:
①在三颈烧瓶中加入一定量冰醋酸与浓H2SO4的混合液体,再缓缓加入适量30%的双氧水。
②不断搅拌并控制B中混合液的温度为20~30℃一段时间。
③接入冷凝管和抽气泵,在锥形瓶中收集得到产品。

不同反应物比例,实验测得生成过氧乙酸含量(%)随时间的变化数据(见下表),请回答相关问题:
反应物比例 CH3COOH/H2O2 | 反应时间(小时) | ||||
0.5 | 1 | 3 | 5 | 7 | |
2:1 | 7.38 | 8.46 | 9.42 | 11.26 | 13.48 |
1:1 | 10.56 | 12.92 | 13.54 | 20.72 | 20.70 |
1:2 | 6.14 | 7.10 | 7.96 | 10.38 | 12.36 |
(1)C仪器中冷水流入口是_____(填a或b),生成过氧乙酸的化学方程式是__________。
(2)反应物最佳比例(CH3COOH/H2O2)是______,反应所需时间约________(选填1、3、5、7)小时。
(3)为更好控制反应温度,应增加的措施是________。
(4)请设计实验比较Fe3+、Cu2+对过氧乙酸的催化效率。
可供选择的试剂和器材有:a.过氧乙酸溶液;b.1mol/L的FeCl3溶液;c.0.5mol/L的Fe2(SO4)3溶液;d. 0.5mol/L的CuCl2溶液;e.1mol/L的CuSO4溶液;f.计时器;g.测量气体体积的针筒。
你选择的试剂及器材是a、________、f、g(选填序号)实验方案是____________。
(5)产品含量测定。
取2.00mL过氧乙酸试样稀释成100mL,从中取出5.00mL,滴加酸性KMnO4溶液至恰好粉红色,以除去残余H2O2,加入10mL10%KI溶液和几滴淀粉溶液,摇匀,用0.1000mol/L的Na2S2O3标准液达到至终点(反应方程式为2Na2S2O3+I2=Na2S4O6+2NaI),共消耗13.20mL,Na2S2O3标准液。该样品中过氧乙酸的物质的量浓度是____________。