��Ŀ����
����Ŀ��ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W,����X��Z��W����Ԫ�ؿ����XH3��H2Z��HW���ۻ�����;Y����Ԫ�ؿ����Y2O��Y2O2�����ӻ����
(1)Y2O2���еĻ�ѧ���зǼ��Թ��ۼ���_____,�û���������______������ӻ���� �������ۻ��������
(2)�õ���ʽ��ʾY2O���γɹ���______________________________��
(3)Z��W����Ԫ�ص�����������Ӧ��ˮ������,������ǿ��ˮ������_____(�ѧʽ)��
(4)X������ɵĻ�������, �Ⱥ��м��Թ��ۼ��ֺ��зǼ��Թ��ۼ��Ļ�����Ľṹʽ__________��
(5)��X��W��ɵĻ����������,X��Wԭ�ӵ��������ﵽ8�����ȶ��ṹ,�û�������ˮ���������ֻ��������һ�־���Ư����,��һ����ʹʪ��ĺ�ɫʯ����ֽ������д���û�������ˮ��Ӧ�Ļ�ѧ����ʽ_________________��
���𰸡� ���Ӽ� ���ӻ����� ![]() HClO4
HClO4 ![]() NCl3+3H2O
NCl3+3H2O![]() 3HClO+NH3
3HClO+NH3
��������ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W��Y����Ԫ�ؿ����Y2O��Y2O2���ӻ������YΪ��Ԫ�أ�X��Z��W����Ԫ�ؿ����XH3��H2Z��HW���ۻ����Xԭ��������С���ƣ�����XΪ��Ԫ�أ�Z��Wԭ�������������ƣ�ZΪ��Ԫ�أ�WΪ��Ԫ�أ�
(1)�������Ƶĵ���ʽΪ![]() �����к��еĻ�ѧ��Ϊ���Ӽ������ۼ��������ӻ����
�����к��еĻ�ѧ��Ϊ���Ӽ������ۼ��������ӻ����
(2)Na2O�����ӻ���������ʽ�γɹ���Ϊ![]() ��
��
(3)��Ԫ�طǽ����Ա���Ԫ��ǿ��������Ԫ�ص�����������Ӧ��ˮ������,������ǿ��ˮ������HClO4��
(4)N��H�γɵļȺ��м��Թ��ۼ��ֺ��зǼ��Թ��ۼ��Ļ�����ΪN2H4����ṹʽΪ![]() ��
��
(5)��X��W��ɵĻ���������У�X��Wԭ�ӵ��������ﵽ8�����ȶ��ṹ����û�����ΪNCl3����ˮ������һ�־���Ư���ԵĻ�����Ϊ�������һ�ִ̼�����ζ��������Ϊ��������Ӧ�Ļ�ѧ����ʽΪNCl3+3H2O�T3HClO+NH3��

 �Ķ��쳵ϵ�д�
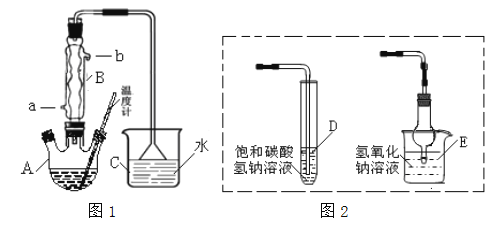
�Ķ��쳵ϵ�д�����Ŀ���±����и��������У�����֮��ͨ��һ����Ӧ����ʵ������ͼ��ʾת������
ѡ�� | X | Y | Z |
A | Na | NaOH | NaCl |
B | Si | SiO2 | Na2SiO3 |
C | Cl2 | HClO | NaClO |
D | NO | NO2 | HNO3 |

A. A B. B C. C D. D