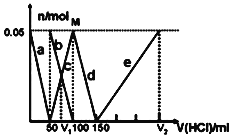
题目内容
【题目】碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·x H2O]常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和_________。
(2)MgaAlb(OH)c(CO3)d·x H2O中a、b、c、d的代数关系式为_________________。
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
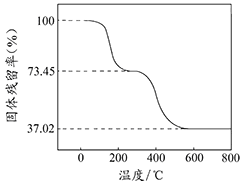
①准确称取3.390g样品与足量稀盐酸充分反应,生成CO20.560L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如右图所示(样品在2700C时已完全失去结晶水,6000C以上残留固体为金属氧化物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-): n(CO32-)(写出计算过程)________。
【答案】阻止燃烧 2a+3b=c+2d 3:5(过程见解析)
【解析】
(1)碱式碳酸铝镁[MgaAlb(OH)c(CO3)dxH2O]受热分解最终生成MgO、Al2O3,MgO、Al2O3的熔点较高且都不燃烧,所以有阻燃作用,故答案为生成的产物具有阻燃作用;
(2)化合物中各元素化合价的代数和为0,所以2a+3b+c+4d=(c+3d)×2,所以得2a+3b=c+2d,故答案为2a+3b=c+2d;
(3)n(CO2)= ![]() =2.50×10-2mol,m(CO2)=2.50×10-2mol×44g/mol=1.10g,在270℃~600℃之间,失去结晶水后的样品进一步受热分解生成CO2、H2O,m(CO2)+m(H2O)=3.390g×(0.7345-0.3702)=1.235g,m(H2O)=1.235g-1.10g=0.135g,n(H2O)=
=2.50×10-2mol,m(CO2)=2.50×10-2mol×44g/mol=1.10g,在270℃~600℃之间,失去结晶水后的样品进一步受热分解生成CO2、H2O,m(CO2)+m(H2O)=3.390g×(0.7345-0.3702)=1.235g,m(H2O)=1.235g-1.10g=0.135g,n(H2O)=![]() =7.50×10-3 mol,再根据氢原子守恒得n(OH-)=2n(H2O)=1.50×10-2 mol,根据C原子守恒得n(CO32-)=n(CO2)=2.50×10-2mol,所以n(OH-):n(CO32-)=1.50×10-2 mol:2.50×10-2mol=3:5,答:碱式碳酸铝镁样品中的n(OH-):n(CO32-)=3:5。
=7.50×10-3 mol,再根据氢原子守恒得n(OH-)=2n(H2O)=1.50×10-2 mol,根据C原子守恒得n(CO32-)=n(CO2)=2.50×10-2mol,所以n(OH-):n(CO32-)=1.50×10-2 mol:2.50×10-2mol=3:5,答:碱式碳酸铝镁样品中的n(OH-):n(CO32-)=3:5。

【题目】某学校课外活动小组仅有一大一小两试管和氢氧化钠溶液。甲、乙两个同学找来铝制废牙膏皮,各自设计了一套装置如下图,制取并收集一试管氢气。
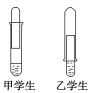
(1)哪个学生设计的装置比较合理?____(填“甲”或“乙”),另一设计装置不合理的原因____________
(2)用比较合理的装置制取氢气,要使氢气充满收集氢气的试管,应该采取的措施是____。
(3)还可以用哪些常见物品和试剂代替废牙膏皮和氢氧化钠溶液完成实验?_____________
(4)测定H2和空气混合气体的爆炸范围实验如下所述。取10支大试管,依次盛水90%(体积分数)、80%……再用排水集气法收集H2,而后分别把试管口移近酒精灯火焰,实验结果如下:
H2体积分数/% | 90 | 80 | 70 | 60~20 | 10 | 5 |
空气体积分数/% | 10 | 20 | 30 | 40~80 | 90 | 95 |
点燃现象 | 安静 燃烧 | 安静 燃烧 | 弱爆炸 | 强爆炸 | 弱爆炸 | 不燃烧 不爆炸 |
由上述实验结果评价:用向下排空气法收集H2,保持试管倒置移近火焰,如果只发出轻微的“噗声”,表示收集的H2已纯净的说法的真正涵义:________________________。
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向KI溶液中滴入少量新制氯水和四氯化碳,振荡、静置,溶液下层呈紫红色 | I的还原性强于Cl |
B | 向无水乙醇中加入浓H2SO4,加热,将产生的气体通入酸性KMnO4溶液,紫红色褪去 | 该气体一定是乙烯 |
C | 测定Na2CO3和Na2SiO3溶液的pH,后者pH比前者的大 | C的非金属性比Si强 |
D | 向1-溴丙烷中加入KOH溶液,加热几分钟,冷却后再加入AgNO3溶液,无淡黄色沉淀生成 | 1-溴丙烷没有水解 |
A.AB.BC.CD.D