题目内容
10.下列物质中,含有共价键的离子化合物的是( )| A. | CaCl2 | B. | KOH | C. | H2SO4 | D. | CH3Cl |
分析 非金属元素之间易形成共价键,活泼金属和活泼非金属元素之间易形成离子键,只含共价键的化合物为共价化合物,共价化合物中一定不含离子键,以此来解答.
解答 解:A.CaCl2只含有离子键,故A不选;
B.含钾离子与氢氧根离子形成的离子键,含有O-H共价键,属于离子化合物,故B选;
C.H2SO4只含共价键,属于共价化合物,故C不选;
D.CH3Cl只含共价键,属于共价化合物,故D不选.
故选B.
点评 本题考查共价化合物,注意共价化合物中一定不含离子键,明确常见物质中的化学键为解答的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列物质只用一种试剂不能鉴别的是( )
| A. | 用氢氧化钠溶液鉴别己烷、四氯化碳、乙醛 | |
| B. | 用燃烧法鉴别乙醇、苯、CCl4 | |
| C. | 用溴水鉴别苯酚、葡萄糖、苯、CCl4 | |
| D. | 用酸性高锰酸钾溶液鉴别苯、环己烯和环己烷 |
8.下列叙述正确的是( )
| A. | NaHCO3俗名纯碱,可用作发酵粉 | B. | Mg(OH)2可用作治疗胃酸过多的药剂 | ||
| C. | CaCO3可用作高温材料 | D. | Na2O2可用作自来水的消毒剂 |
5.下列叙述正确的是( )
| A. | 室温下AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| B. | 室温下1mL pH=1的盐酸与100mL NaOH溶液混合后溶液的pH=7,则NaOH溶液的pH=11 | |
| C. | 浓度均为0.1mol/L的CH3COOH与CH3COONa混合溶液(pH=5.6)中,c(Na+)>c(CH3COO-) | |
| D. | 0.1mol•L-1的碳酸氢钠溶液中:c(Na+)=c(HCO3-)+c(H2CO3) |
5.NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A. | 28g乙烯和环丁烷(C4H8)的混合气体含有的碳原子数为2NA | |
| B. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| C. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| D. | 0.5 mol 1,3-丁二烯分子中含有C=C双键数为 NA |
15.0.5mol硝酸铵在一定条件下可分解成18g水以及另外一种气态物质,该气态物质可能是( )
| A. | NO | B. | N2O | C. | N2O3 | D. | N2 |
2.咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示,关于咖啡鞣酸的下列叙述正确的是( )


| A. | 分子式为C16H18O9 | |
| B. | 1mol咖啡鞣酸水解时可消耗8mol NaOH | |
| C. | 1mol 咖啡鞣酸最多可消耗Br2 6 mol | |
| D. | 能发生取代反应和加成反应,但不能消去反应 |
19.下列说法正确的是( )
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 所有金属与所有非金属原子之间都能形成离子键 | |
| C. | 因为离子键是一种强相互作用,所以离子化合物均很难分解 | |
| D. | 含有离子键的化合物一定是离子化合物 |
20.下列化学用语正确的是( )
| A. | 2-乙基-1,3-丁二烯分子的键线式: | B. | 丙烷分子的比例模型: | ||
| C. | 甲醛的电子式: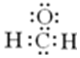 | D. | 聚丙烯的结构简式: |