题目内容
5.下列叙述正确的是( )| A. | 室温下AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| B. | 室温下1mL pH=1的盐酸与100mL NaOH溶液混合后溶液的pH=7,则NaOH溶液的pH=11 | |
| C. | 浓度均为0.1mol/L的CH3COOH与CH3COONa混合溶液(pH=5.6)中,c(Na+)>c(CH3COO-) | |
| D. | 0.1mol•L-1的碳酸氢钠溶液中:c(Na+)=c(HCO3-)+c(H2CO3) |
分析 A.同浓度的CaCl2和NaCl溶液,c(Cl-)不同,浓度越大,对AgCl溶解的抑制程度越大;
B.混合后溶液的pH=7,则1mL×10-3L/mL×0.1mol/L=100mL×10-3L/mL×c(NaOH);
C.浓度均为0.1mol/L的CH3COOH与CH3COONa混合溶液,由pH=5.6可知,醋酸的电离大于醋酸根离子的水解;
D.碳酸氢钠中n(Na)=n(C),结合物料守恒来解答.
解答 解:A.同浓度的CaCl2和NaCl溶液,c(Cl-)不同,浓度越大,对AgCl溶解的抑制程度越大,则室温下AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不同,故A错误;
B.混合后溶液的pH=7,则1mL×10-3L/mL×0.1mol/L=100mL×10-3L/mL×c(NaOH),解得c(NaOH)=0.001mol/L,则NaOH溶液的pH=11,故B正确;
C.浓度均为0.1mol/L的CH3COOH与CH3COONa混合溶液,由pH=5.6可知,醋酸的电离大于醋酸根离子的水解,则c(Na+)<c(CH3COO-),故C错误;
D.碳酸氢钠中n(Na)=n(C),由物料守恒可知碳酸氢钠溶液中c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故D错误;
故选B.
点评 本题考查酸碱混合及难溶电解质,为高频考点,把握溶解平衡移动、酸碱混合的计算、水解与电离的应用为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的易错点,题目难度不大.

练习册系列答案
相关题目
16.已知:4P(红磷,s)+5O2(g)═2P2O5(s) 放热a kJ;4P(白磷,s)+5O2(g)═2P2O5(s) 放热b kJ
常温下红磷比白磷稳定,则a与b的大小关系是( )
常温下红磷比白磷稳定,则a与b的大小关系是( )
| A. | a<b | B. | a=b | C. | a>b | D. | 无法确定 |
20.如图所示,用石墨电极电解CuCl2溶液.下列分析正确的是( )
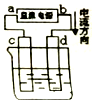

| A. | b为阳极、a为阴极 | |
| B. | 通电一段时间后,d极附近观察到黄绿色气体 | |
| C. | 阳极上发生的反应:Cu2++2e-═Cu | |
| D. | 若电路中转移0.2mole-,则d极增重6.4g |
3.氰酸铵(NH4OCN)与尿素[CO(NH2)2]( )
| A. | 都是共价化合物 | B. | 都是离子化合物 | C. | 都含有共价键 | D. | 互为同素异形体 |
10.下列物质中,含有共价键的离子化合物的是( )
| A. | CaCl2 | B. | KOH | C. | H2SO4 | D. | CH3Cl |
7.在一密闭容器中通入A、B、C三种气体,保持一定温度,在t1~t4 s时测得各物质的浓度如表,则下列判断正确的是( )
| 测定时刻/s 浓度 | t1 | t2 | t3 | t4 |
| c(A)/(mol•L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol•L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol•L-1) | 1 | 2.5 | 3 | 3 |
| A. | 在t3 s时反应已经停止 | |
| B. | t3~t4 s内正、逆反应速率不相等 | |
| C. | 在容器中发生的反应为A(g)+B(g)??C(g) | |
| D. | 在t2~t3 s内A的平均反应速率为$\frac{1}{{t}_{3}-{t}_{2}}$ mol/(L•s) |
8.已知最简单的有机物E和直线型分子G在光照条件下反应,生成四面体型分子L和直线型分子M(组成G分子的元素为第三周期的元素),如图.则下列判断错误的是( )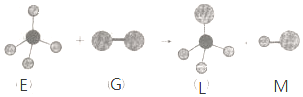

| A. | 常温常压下,E是一种无色无味的气体 | |
| B. | 干燥的G能漂白有色物质 | |
| C. | 在光照条件L能与 G继续发生与上述类似的反应 | |
| D. | 上述反应类型是取代反应 |


 Cu3N具有良好的电学和光学性能,其晶胞结构如图,Cu+半径为apm,N3-半径为bpm,Cu+和N3-都是紧密接触的刚性小球,则N3-的配位数为6,Cu3N的密度为$\frac{1.03×1{0}^{32}}{4(a+b)^{3}{N}_{A}}$g•cm-3.(化为最简式)
Cu3N具有良好的电学和光学性能,其晶胞结构如图,Cu+半径为apm,N3-半径为bpm,Cu+和N3-都是紧密接触的刚性小球,则N3-的配位数为6,Cu3N的密度为$\frac{1.03×1{0}^{32}}{4(a+b)^{3}{N}_{A}}$g•cm-3.(化为最简式)