题目内容
①电解池中电极反应的方程式是
阴极: ,阳极: 。
②写出生成氯酸钾的离子方程式,并标明电子转移的方向和数目 。
第二种,无隔膜电解热的氯化钠水溶液,然后用电解后溶液中的一种产物与等物质的量的氯化钾水溶液混合制得氯酸钾。
③第二种方法中制得氯酸钾的化学方程式是 ,该反应能够进行的原因是 。
④已知下列各物质的价格如下表:
| 物质 | NaCl | KCl | NaClO3 | KClO3 | KOH |
| 价格(元/50kg) | 500 | 1900 | 4200 | 26000 | 10600 |
。
① 2H++2e—==H2↑(1分),2Cl——2e—="=" Cl 2↑(1分)
② (2分)
(2分)
③NaClO3+KCl==KClO3+NaCl(2分);四种物质中氯酸钾的溶解度最小,可以从溶液中析出,使反应向着生成氯酸钾的方向进行。(2分)
④第二种(1分)
第一种方法中生成KClO3时只利用了原料KCl的1/6,其余5/6又恢复为原料KCl,而KCl的价格高于NaCl,这在经济上是低效益的。(2分)
②
 (2分)
(2分)③NaClO3+KCl==KClO3+NaCl(2分);四种物质中氯酸钾的溶解度最小,可以从溶液中析出,使反应向着生成氯酸钾的方向进行。(2分)
④第二种(1分)
第一种方法中生成KClO3时只利用了原料KCl的1/6,其余5/6又恢复为原料KCl,而KCl的价格高于NaCl,这在经济上是低效益的。(2分)
①由离子的放电顺序知,氢离子比钾离子易放电,氯离子比氢氧根离子易放电,故阴极是氢离子放电,阳极是氯离子放电,电极反应式为,阴极: 2H++2e—==H2↑
阳极:2Cl——2e—="=" Cl 2↑
②电解生成了氢气、氯气、氢氧化钾,要得到氯酸钾,很明显是氯气与氢氧化钾在加热条件下反应得到的,故其离子反应式及电子转移的方向和数目为: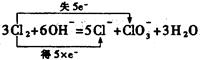
③电解氯化钠溶液与电解氯化钾溶液的电极反应是一样的,即电解后得到氯酸钠溶液,氯酸钠再与等物质的量氯化钾反应生成氯酸钾,而另一产物必然是氯化钠,反应方程式为:NaClO3+KCl==KClO3+NaCl,该反应为一个复分解反应,之所以可以向生成氯酸钾的方向进行只能是氯酸的溶解度小,可以从溶液中析出,从而降低溶液中钾离子和氯酸根离子的浓度。
④从价格上明显可以看出氯化钾比氯化钠的价格要高得多,而第一种方法氯化钾的利用率只有1/6,第二种方法氯化钾的利用率为100%,故第二种方法更好,理由是第一种方法中生成KClO3时只利用了原料KCl的1/6,其余5/6又恢复为原料KCl,而KCl的价格高于NaCl,这在经济上是低效益的。
阳极:2Cl——2e—="=" Cl 2↑
②电解生成了氢气、氯气、氢氧化钾,要得到氯酸钾,很明显是氯气与氢氧化钾在加热条件下反应得到的,故其离子反应式及电子转移的方向和数目为:
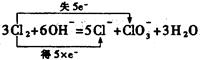
③电解氯化钠溶液与电解氯化钾溶液的电极反应是一样的,即电解后得到氯酸钠溶液,氯酸钠再与等物质的量氯化钾反应生成氯酸钾,而另一产物必然是氯化钠,反应方程式为:NaClO3+KCl==KClO3+NaCl,该反应为一个复分解反应,之所以可以向生成氯酸钾的方向进行只能是氯酸的溶解度小,可以从溶液中析出,从而降低溶液中钾离子和氯酸根离子的浓度。
④从价格上明显可以看出氯化钾比氯化钠的价格要高得多,而第一种方法氯化钾的利用率只有1/6,第二种方法氯化钾的利用率为100%,故第二种方法更好,理由是第一种方法中生成KClO3时只利用了原料KCl的1/6,其余5/6又恢复为原料KCl,而KCl的价格高于NaCl,这在经济上是低效益的。

练习册系列答案
相关题目





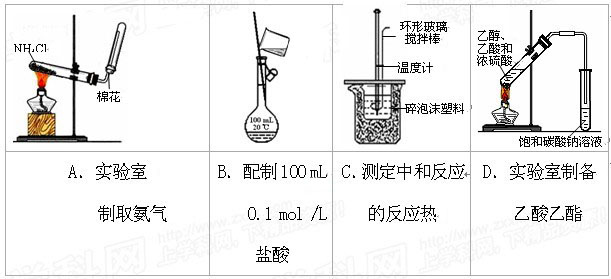
 或操作不能达到实验目的的是
或操作不能达到实验目的的是