题目内容
14.(1)为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3).碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4═3I2+3K2SO4+3H2O①该反应中,氧化剂是KIO3,氧化产物是I2.
②当有3mol I2生成时,有5 mol还原剂被氧化.
③当有1mol氧化剂参与反应时,转移电子的物质的量为5 mol.
(2)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,这个事实说明具有还原性的粒子还原性强弱为:Fe2+>Br->Cl-.足量Cl2通入FeBr2溶液中离子方程式为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-.
分析 (1)KIO3+5KI+3H2SO4═3I2+3K2SO4+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,以此来解答.
(2)一种氧化剂与多种还原剂反应时,先与还原性强的反应;足量Cl2通入FeBr2溶液生成Br2和氯化铁.
解答 解:①KIO3中I元素的化合价降低,作氧化剂,被还原,对应还原产物为I2,KI中I元素的化合价升高被氧化,对应氧化产物也为I2,
故答案为:KIO3;I2;
②由反应可知,3mol I2生成时,有5 molKI作还原剂被氧化,故答案为:5;
③当有1mol氧化剂参与反应时,转移电子的物质的量为1mol×(5-0)=5 mol,故答案为:5.
(2)一种氧化剂与多种还原剂反应时,先与还原性强的反应,将少量Cl2通入FeBr2的溶液中,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,Fe2+被氧化,Br-没有被氧化,则还原性:Fe2+>Br-,Cl-是还原产物还原性最弱,所以还原性:Fe2+>Br->Cl-;足量Cl2通入FeBr2溶液生成Br2和氯化铁,其反应的离子方程式为:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-;
故答案为:Fe2+>Br->Cl-;2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-.
点评 本题考查氧化还原反应,把握氧化还原反应中元素的化合价变化及氧化还原反应基本概念、转移电子的计算为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.有关甲苯的实验事实中,能说明苯环对侧链性质的影响的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色 | |
| B. | 甲苯与浓硫酸和浓硝酸混酸反应生成2,4,6-三硝基甲苯 | |
| C. | 1mol甲苯能与3mol氢气发生加成反应 | |
| D. | 甲苯可以燃烧并产生浓烈的黑烟 |
2.下列实验现象描述不正确的是( )
| 选项 | 实 验 | 现 象 |
| A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着 |
| C | 在FeCl2溶液中滴入NaOH溶液 | 先生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
| D | 在空气中久置的铝条放入NaOH溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| A. | A | B. | B | C. | C | D. | D |
9.下列变化需要加入适当的氧化剂才能完成的是( )
| A. | CuO→CuSO4 | B. | Fe→FeCl2 | C. | H2SO4→H2 | D. | HNO3→N2 |
19.青石棉是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2.青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是( )
| A. | 青石棉是一种硅酸盐材料 | |
| B. | 青石棉中含有一定量的石英晶体 | |
| C. | 青石棉的化学组成可表示为Na2O•3FeO•Fe2O3•8SiO2•H2O | |
| D. | 1mol青石棉能使1molHNO3被还原 |
6.下列反应的离子方程式,书写正确的是( )
| A. | 氢氧化钠溶液与盐酸反应:OH-+H+═H2O | |
| B. | H2SO4溶液中滴入Ba(OH)2溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| D. | 氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO42-═BaSO4↓ |
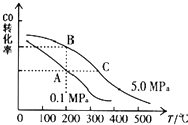 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题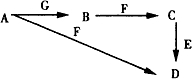 A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色的固体.它们的相互转化如图所示,部分生成物未列出.试回答下列问题
A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色的固体.它们的相互转化如图所示,部分生成物未列出.试回答下列问题